QUÁ TRÌNH THIẾT bị CNSH
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.83 MB, 34 trang )
QUÁ TRÌNH VÀ THIẾT BỊ CNSH
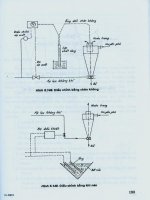
Câu 1.1: Nguyên lý chung của phương pháp sắc ký cột, kèm sơ đồ ?
a) Nguyên lý hoạt động của sắc ký cột
- Dung dịch cần phân tích đi qua 1 cột được nhồi bởi một loại vật liệu có khả năng hấp
phụ chọn lọc.
- Các chất hòa tan sẽ phân bố ≠ nhau giữa pha di động (lỏng) và pha tĩnh (cột hấp phụ).
- Dung dịch ra khỏi cột sau những khoảng TG khác nhau sẽ được thu thành các phân
đoạn khác nhau.
- Sắc ký đồ mô tả mối quan hệ giữa các chất trong các phân đoạn theo thời gian
- Sơ đồ nguyên lý của phương pháp sắc ký cột:
b) Hệ thống sắc ký cột
- Thành phần cơ bản trong hệ thống sắc ký cột gồm cột sắc ký, chất nhồi cột, dung môi,
detector và computer.
- Cột sắc ký giống như cái burette, gồm 1 ống thủy tinh và 1 cái khóa, nhưng khơng cần
vạch chia độ, kích thước cột thay đổi từ nhỏ đến lớn.
- Chất nhồi cột (pha tĩnh) thường dùng là silica gel, có 2 loại là silica gel pha thuận và
silica gel pha đảo (silica gel pha thuận thường dùng hơn, gồm Si có đính các nhóm OH,
silica gel pha đảo gồm Si có đính các gốc alkan R), ngồi ra cịn dùng alumina, florisil.
Chất nhồi cột quyết định quá trình sắc ký. Nếu dùng pha thuận, silica gel có gắn nhóm OH
sẽ giữ chặt các chất phân cực hơn, các chất không phân cực liên kết với silica gel yếu nên
sẽ ra trước, các chất phân cực hơn sẽ ra sau. Ngoài ra, tùy thuộc vào lượng mẫu mà sẽ
dùng lượng silica gel bao nhiêu, từ đó sẽ chọn kích cỡ cột sắc ký thích hợp.
- Việc chọn dung mơi phụ thuộc vào chất nhồi cột. Nếu dùng silica gel pha thuận (phân
cực) thì chọn dung mơi đi từ khơng phân cực đến phân cực (ví dụ từ chloroform đếm
methanol), thông thường dùng hỗn hợp dung môi. Chú ý dung môi chạy sắc ký cột phải
phân cực hơn một chút so với dung mơi chạy sắc ký bản mỏng vì hạt silica gel dùng cho
cột sắc ký sẽ to hơn hạt trên bản mỏng nên khả năng tách sẽ kém hơn một chút.
- Mơ hình hệ thống sắc ký cột:
Câu 1.2: Cấu tạo của hệ thống tinh sạch protein Biologic DuoFlow (Bio-Rad), kèm
sơ đồ ?
- Mặc dù hệ thống Biologic DuoFlow có nhiều cấu hình khác nhau nhưng tất cả chúng
đều dựa trên một cấu tạo cơ bản bao gồm:
+ Máy tính điều khiển và bộ truyền kết nối.
+ Máy trạm
+ Maximizer
+ Bộ trộn có 2 loại là MX-1 mixer và Maximizer mixer.
+ Hệ thống phát hiện: Đầu dò UV, đầu dò QuadTec, bộ giám sát độ dẫn, và bộ giám
sát pH.
+ Hệ thống van: AVR7-3, AVR9-8, SV5-4, và SVT3-2.
+ Bộ thu hồi phân đoạn: BioFrac, Model 2128 và Model 2110.
+ Bộ phận nạp mẫu: DynaLoop, EP-1 Econo Pump, và EGP Econo Gradient Pump.
+ Các phụ kiện.
+ Cột sắc ký và phụ kiện của cột.
- Sơ đồ cấu tạo hệ thống Biologic DuoFlow (Nguồn: Bio-Rad):
Câu 1.3: Cấu tạo chi tiết của Workstation trong hệ thống Biologic DuoFlow (BioRad), kèm sơ đồ ?
a) Cấu tạo
- Bao gồm: các đầu bơm kép, mỗi đầu bơm kép có 2 piston kép tương ứng, 1 bộ chuyển
đổi áp suất được đặt trong máy trạm ở đầu ra của bơm. Bộ chuyển đổi áp suất có chức
năng đo áp suất hệ thống, được hiển thị trên thanh trạng thái phía dưới màn hình Manual
and Run. Các nút rửa (Purge) A và B, và nút tạm dừng (Pause) được bố trí ở mặt trước của
máy trạm.
- Có 2 loại bơm gradient trong máy trạm là F10 và F40 (bơm F10 có tốc độ bơm tối đa
là 10 mL/phút ở áp suất tối đa 3.500 psi, còn bơm F40 là 40 mL/phút ở 1.000 psi).
- Chức năng các nút trên bảng điều khiển của máy trạm
+ Nút nguồn (power): Đóng và mở nguồn điện của máy trạm và các bộ phận kết nối
với nó.
+ Nút tạm dừng (pause): Tạm dừng các bơm của máy trạm hoặc tạm dừng một
phương pháp đang chạy. Khi nó được nhấn, trạng thái đèn LED của các bơm A và B thay
đổi từ màu xanh lục sang nhấp nháy đỏ. Để tiếp tục chạy:
Nhấn nút một lần nữa để khởi động các bơm và phương pháp, hoặc:
Nhấn nút Continue trong màn hình Run, hoặc:
Nhấn nút START trong màn hình Manual.
+ Nút rửa A và B (Purge A & B): Trước khi nhấn một trong hai nút Purge, chuyển
valve tiêm AVR7-3 tới vị trí Purge trong màn hình Manual để cột sắc ký khơng chịu áp
suất và tốc độ dịng chảy cao.
Các nút Purge có các đường ống chứa dung dịch được kết nối với bơm A và B. Khi
nút được nhấn, đèn LED màu xanh lục cho bơm A và B nhấp nháy. Để dừng dòng chảy,
nhấn nút Purge một lần nữa và đèn LED tắt. Các nút này không hoạt động khi hệ thống
đang chạy một phương pháp.
Khi các nút Purge được nhấn, các đầu bơm sẽ chạy ở tốc độ tối đa (mặc định) của
chúng (F10 là 10 mL/phút hoặc 20 mL/phút khi sử dụng Maximizer, F40 là 40 mL/phút
hoặc 80 mL/phút khi sử dụng Maximizer). Để thay đổi tốc độ dòng chảy mặc định, chọn
Manual Setup từ Options drop-down menu.
+ Đèn cảnh báo (alert light): Đèn LED này có các chức năng sau:
Màu đỏ: Chỉ bơm đã bị tắt do sự cố về cơ hoặc điện, và cũng có thể do giới hạn áp
suất cao hoặc thấp đã vượt quá ngưỡng. Giới hạn áp suất được cài đặt trong màn hình
Manual và Run.
Màu đỏ nhấp nháy: Xuất hiện trong quá trình chạy một phương pháp và chỉ ra rằng
đã có một bước ALARM lập trình trước. Bộ phận điều hành hệ thống phải đáp ứng trước
khi phương pháp tiếp tục.
Màu xanh lục: Chỉ bơm đang chạy.
- Chức năng các cổng phía trước máy trạm
+ Cổng khởi động A và B: Làm nhiệm vụ khởi động các bơm chính.
+ Cổng bơm mẫu vào/ra: Vị trí gắn các đầu bơm để bơm mẫu vào/ra khỏi hệ thống.
+ Cổng chuyển đổi áp suất vào/ra: Vị trí của bộ chuyển đổi áp suất vào và ra của hệ
thống.
+ Cổng bơm dịch rửa vào/ra: Vị trí gắn các đầu bơm để bơm dịch rửa nhằm loại bỏ
các muối kết tinh hoặc cặn bẩn để làm sạch các piston.
b) Sơ đồ mặt trước của Workstation
Câu 1.4: Tính năng của hệ thống Biologic DuoFlow (Bio-Rad) và các bước cơ bản
trong q trình sắc ký.
a) Tính năng nổi bật của hệ thống
- Thiết kế kiểu module chồng nhau phù hợp với khơng gian phịng thí nghiệm. Khay
và thanh dọc có thể di chuyển và tháo rời. Thanh ngang có thể đặt ở vị trí tối ưu cho các
loại van, cột và đầu dò.
- Dễ nâng cấp cấu hình, phần mềm dễ sử dụng.
- Bộ trộn đệm: có khả năng trộn đệm có nồng độ muối và pH cụ thể.
- Thăm dị: tính năng này giúp chọn các điều kiện tối ưu cho quá trình sắc ký thơng
qua thăm dị pH, thời gian, cột, đệm, tốc độ dịng và số lượng mẫu.
- Phương pháp: có thể chạy nhiều loại sắc ký trong hệ thống như: ái lực, tương tác kỵ
nước, trao đổi ion và lọc gel.
- Bộ giám sát pH: theo dõi trực tiếp giá trị pH trong quá trình sắc ký.
- Tốc độ bơm và hệ thống đầu dò linh hoạt: lưu lượng từ 0,01-80 mL/phút với các
loại đầu bơm khác nhau. Hệ thống đầu dò đa dạng, phổ hấp thụ rộng tạo nên tính linh
động cho hệ thống.
- Bộ thu hồi phân đoạn: hệ thống hỗ trợ thiết lập nhiều dạng thu hồi sản phẩm: thu hồi
toàn bộ, thu hồi một phần, và thu theo ngưỡng.
- Nhiều lựa chọn cho van: Máy trạm cung cấp kết nối cho 3 van áp suất cao và 3 van
áp suất thấp. Bổ sung Maximizer làm tăng gấp đôi khả năng: 6 van áp suất cao và 6 van áp
suất thấp.
- Bộ kit khởi động và UNO Q1 anion exchange column: gồm có các thuốc thử cần
thiết, mẫu protein và cột chạy thử nghiệm sắc ký trao đổi anion.
b) Các bước cơ bản trong q trình sắc ký
Có rất nhiều cấu hình được Bio-Rad đưa ra, nhưng nhìn chung bất kỳ một cấu hình nào
của hệ thống Biologic DuoFlow cũng đều trải qua các bước thực hiện cơ bản sau:
- Thiết lập hệ thống: Lắp ráp và kết nối các bộ phận của hệ thống như van, đầu dò,
máy trạm, máy tính, máy đo pH… lại với nhau.
- Chọn cột sắc ký: Cột được lựa chọn lắp vào hệ thống phải phù hợp với mục đích và
phương pháp sắc ký.
- Khởi động phần mềm: Mở trình duyệt chạy ch/trình Biologic DuoFlow Software.
- Chọn phương thức hoạt động: Chọn phương thức mặc định của chương trình hoặc
phương thức thiết lập thủ công.
- Cài đặt các thông số: Điều chỉnh các thông số kỹ thuật cần thiết như loại sắc ký, tốc
độ dịng, áp suất, bước sóng hấp thụ… với thanh cơng cụ (toolbar) của chương trình.
- Chạy để nạp mẫu: Các phương pháp tải mẫu được lựa chọn sao cho phù hợp với thể
tích mẫu, tốc độ bơm, tốc độ dịng…
- Thu hồi sản phẩm
Câu 1.5: Nguyên lý chung của quá trình điện di, kèm sơ đồ
a) Nguyên lý chung
Điện di là hiện tượng dịch chuyển của các phân tử tích điện dưới tác động của điện
trường, hay nói cách khác là kỹ thuật phân tách các phân tử DNA, RNA và protein dựa
trên các đặc điểm vật lý như khối lượng hay điện tích thực của chúng.
Khi các phân tử tích điện được đặt trong một điện trường, chúng sẽ dịch chuyển về cực
dương (+) hoặc âm (-) tùy theo điện tích của chúng. Protein có điện tích thực hoặc dương
hoặc âm, cịn các nucleic acid có một điện tích âm khơng đổi nhờ khung đường-phosphate
của mình và vì thế chỉ dịch chuyển hướng đến cực dương
Các phân tử protein và nucleic acid có thể được chạy điện di trên một khuôn đỡ như
giấy, cellulose acetate, gel tinh bột, agarose hoặc polyacrylamide gel. Tuy nhiên, kỹ thuật
điện di trên agarose hoặc polyacrylamide là phổ biến nhất. Kỹ thuật này sử dụng một dung
dịch đệm để dẫn điện và tạo điện trường đều, một bản gel để phân tách các phân tử, và các
chất nhuộm khác nhau để phát hiện vị trí các phân tử trên gel sau khi điện di. Trong đó,
polyacrylamide gel được dùng để phân tách các phân tử protein và các phân tử DNA có
kích thước <1 kb, còn agarose gel phân tách hiệu quả các phân tử DNA hoặc RNA có kích
thước từ 20 bp-20 kb.
Điện di được thực hiện với hai loại cấu hình chính là điện di chiều nằm ngang và chiều
thẳng đứng. Chúng cơ bản là giống nhau, chỉ khác sau ở một số đặc điểm
b) Sơ đồ nguyên lý của kỹ thuật điện di
Câu 1.6: So sánh đặc điểm của hai cấu hình thiết bị điện di khác nhau: điện di
chiều nằm ngang và điện di chiều thẳng đứng
Câu 1.7: Cấu tạo của hệ điện di chiều nằm ngang Sub-Cell GT System (Bio-Rad),
kèm sơ đồ.
- Buồng điện di: là nơi đặt gel trong q trình điện di. Buồng có rãnh để cài lược, 2
điện cực bằng platinium (đường kính 0,25 mm) tạo ra điện trường trong dung dịch.
- Thanh chắn gel: dùng để đúc gel trực tiếp trên bệ của buồng điện di. Bộ phận này
khơng bắt buộc.
- Nắp an tồn và cáp điện: trên nắp có đầu ra của dây cáp điện nối 2 điện cực trên
buồng điện di với nguồn điện.
- Khn đúc gel có thước huỳnh quang trên khn.
- Khay đổ gel: để đặt khuôn đúc gel. Bộ phận này khơng bắt buộc.
- Lược: có các vị trí đã cố định.
- Bộ nguồn: Đầu ra cung cấp dòng điện một chiều, có các thơng số: điện áp,
cường độ dịng điện, cơng suất khơng đổi. Đầu vào là nguồn điện xoay chiều 100-120
V/220-240 V, 50/60 Hz
Câu 1.8: Cấu tạo của hệ điện di chiều thẳng đứng Mini-PROTEAN Tetra (BioRad), kèm sơ đồ.
- Cấu tạo bao gồm các bộ phận:
+ Tấm đệm: tấm kính gắn cố định vs miếng đệm gel dày 0,75mm; 1mm và 1,5 mm
+ Tấm ngắn: tấm kính phẳng và ngắn hơn tấm đệm, kết hợp với tấm đệm tạo thành
cặp gel cassette.
+ Khung đúc gel: gắn chặt tấm đệm và tấm ngắn tạo thành cặp gel cassette trước khi
đúc gel.
+ Bộ gel cassette: 1 khung đúc gel, 1 tấm đệm, và 1 tấm ngắn tạo thành 1 bộ gel
cassette. Bộ gel đôi: cho phép chạy 3-4 gel.
+ Giá đúc gel: gắn chặt bộ gel cassette trong suốt q trình đúc gel, nó có khóa ép chặt
bộ gel cassette với tấm đệm để khỏi rò rỉ gel.
+ Cặp gel cassette: 1 tấm đệm, 1 tấm ngắn và gel đã được polymer hóa tạo thành cặp
gel cassette.
+ Tấm ngăn đệm: được sử dụng chỉ khi chạy điện di 1 hoặc 3 gel.
+ Bộ điện cực: anode phích cắm có màu đỏ và cathode phích cắm có màu đen.
+ Buồng đệm mini và nắp: tương thích với các module điện cực khác của Bio-Rad
khác để thẩm tích, điện di 1 chiều và 2 chiều, và điện rửa giải
+ Bộ nguồn: PowerPac™ Basic, điện áp: 10-300 V, dịng điện: 4-400 mA, cơng suất
tối đa: 75 W, số buồng điện di chạy được cùng lúc: 4.
- Sơ đồ cấu tạo của hệ thống
Câu 1.9: Sơ đồ cấu tạo của hệ điện di tập trung đẳng điện PROTEAN® IEF Cell
(Bio-Rad), mơ tả các khay R/E và F, máy in và các tính năng của nó.
a) Sơ đồ cấu tạo thân máy chính
b) Khay
Protean IEF Cell có 2 loại khay khác nhau là khay bù nước/cân bằng
(rehydration/equilibration tray) và khay tập trung đẳng điện
- Khay bù nước/cân bằng (R/E): được sử dụng để bù nước cho thanh IPG trước khi
tiến hành điện di tập trung đẳng điện và để cân bằng chúng trong đệm trước khi điện di
chiều thứ hai. Việc sử dụng khay R/E giúp đơn giản việc thao tác với thanh IPG
- Khay tập trung đẳng điện (F): Khay chứa được thanh 12 IPG, có các điện cực để
chạy điện di tập trung đẳng điện và giếng chứa mẫu. Khay F được dùng cho phương pháp
bù nước chủ động hoặc thụ động.
- Khay F cũng có thể dùng để trương nước và chạy tập trung đẳng điện.
c) Máy in
- Protean IEF Cell có thể kết nối với máy tính hay máy in thông qua cổng RS232.
- Protean IEF Cell ghi lại tình trạng chạy máy mỗi 5 phút trong suốt quá trình điện di
đẳng điện. Bản in liệt kê các chi tiết của phương pháp đã được cài đặt và giá trị của tất cả
các thông số trong mỗi bước.
- Bản in cũng chỉ ra sự gián đoạn trong quá trình chạy, chẳng hạn như sự ngắt điện khi
nắp bị mở. Nếu như có sự tiếp xúc kém giữa thanh IPG với điện cực hoặc sự dao động lớn
của điện trở, IEF Cell sẽ giữ điện áp ở mức không đổi 500 V cho đến khi có sự can thiệp
của người sử dụng để ngăn ngừa thanh IPG bị cháy. Nếu phương pháp được chỉnh sửa
trong quá tình chạy thì bản in sẽ cho ra giá trị sửa chữa với dấu sao (*)
Câu 1.10: Các sự cố xuất hiện trong điện di tập trung đẳng điện, nguyên nhân và
cách khắc phục.
Câu 2.1: Nguyên lý chung của kỹ thuật PCR. Trình bày hiệu ứng Peltier và
Peltier ngược.
a) Nguyên lý chung
- Kỹ thuật PCR dựa trên cơ sở phản ứng kéo dài primer nhờ enzyme Taq DNA
polymerase để khuếch đại in vitro các nucleic acid đặc hiệu trong máy PCR.
- Một phản ứng PCR là một chuỗi nhiều chu kỳ nhiệt nối tiếp nhau, mỗi chu kỳ gồm ba
giai đoạn
+ Gây biến tính (denaturation): 90-95oC
+ Ủ để gắn primer (annealing): 40-65oC
+ Kéo dài phân tử (extension): 70-72oC
- Các thành phần tham gia phản ứng PCR gồm có:
+ Taq DNA polymerase (Taq pol)
+ dNTPs (deoxynucleotide triphosphates)
+ Primer (mồi)
+ DNA khuôn mẫu
+ Dung dịch đệm pH
+ Mg2+
b) Hiệu ứng Peltier
Hiệu ứng Peltier: là sự khác biệt nhiệt độ được tạo ra bằng cách đặt một điện áp giữa
hai điện cực được kết nối với một mẫu vật liệu bán dẫn. Hiện tượng này có thể hữu ích khi
người ta cần truyền nhiệt từ mơi trường này vào môi trường khác ở quy mô nhỏ. Hiệu ứng
Peltier là một trong ba loại hiệu ứng nhiệt điện, hai hiệu ứng khác là hiệu ứng Seebeck và
hiệu ứng Thomson.
c) Hiệu ứng Peltier ngược
Hiệu ứng Peltier ngược: là kiểu vận hành ngược lại, nghĩa là khi tạo ra một dịng điện
giữa hai mảnh kim loại thì sẽ tạo ra được một sự khác biệt nhiệt độ giữa chúng: bên này
nóng, bên kia lạnh. Khi thay đổi chiều dịng điện thì nhiệt độ của hai mảnh kim loại cũng
thay đổi ngược lại: bên này lạnh, bên kia nóng
Câu 2.2: Nguyên tắc hoạt động của máy luân nhiệt (PCR) theo nguyên lý Peltier,
kèm sơ đồ minh họa
a) Nguyên tắc hoạt động
- Buồng ủ PCR được làm bằng kim loại dẫn nhiệt cao, đặt trên một module Peltier có 2
mảnh kim loại đặc biệt áp vào nhau, 2 mảnh này được nối với 2 cực của nguồn điện và
được điều chỉnh tự động để dòng điện đi qua thiết bị được thay đổi từ chiều này sang
chiều kia và ngược lại.
- Chính sự đổi chiều dịng điện đã làm cho 2 mảnh kim loại của thiết bị Peltier nóng lên
ở mặt này và lạnh đi ở mặt khác sẽ bị đảo ngược lại nhiệt độ, nghĩa là mặt nóng sẽ bị lạnh
và mặt lạnh sẽ bị nóng lên. Như vậy, chu kỳ nhiệt mà người dùng đã cài đặt sẽ được bộ vi
xử lý của máy sử dụng để điều khiển chiều và cường độ dòng điện đi qua 2 mảnh kim loại
của thiết bị Peltier, làm cho nhiệt độ buồng ủ được tăng giảm theo chu kỳ đã cài đặt. Giữa
2 mảnh kim loại được đặt 1 sensor nhiệt để ghi nhận những thay đổi nhiệt độ của buồng ủ
và truyền về bộ vi xử lý.
b) Sơ đồ
Câu 2.3: Cấu tạo của máy PCR Icycler (Bio-Rad).
- Cấu tạo chung của máy PCR iCycler, gồm các bộ phận chính sau:
+ Màn hình điều khiển
+ Bộ vi xử lý
+ Buồng phản ứng (buồng ủ hay module phản ứng)
a) Màn hình điều khiển
- Lập các chương trình chu kỳ nhiệt và ra các lệnh để máy thực hiện.
- Màn hình điều khiển có 25 phím ở mặt trước, bao gồm:
+ Softkeys F1-F5: Các phím được sử dụng để điều chỉnh thơng qua màn hình và cho
phép các lựa chọn được hiển thị trong màn hình
+ Alphanumeric: Bên phải bàn phím của màn hình là phím mười chữ số (phím 0-9),
được bố trí như các phím trên điện thoại. Mỗi số chính (trừ 1 và 0) được sử dụng để đại
diện cho ba hoặc bốn chữ cái. Các phím chữ và số thường được sử dụng cho việc cài đặt
thời gian, nhiệt độ, và lặp lại các chu kỳ.
+ BACK: Trở về màn hình trước đó.
+ DECIMAL POINT (.): Nhập giá trị số thập phân.
+ CLEAR: Xóa các mục đã nhập vào.
+ SHIFT: Chức năng shift được đặt bên dưới các phím chữ và số. Nếu bấm phím
SHIFT, định nghĩa của các phím mềm sẽ thay đổi.
+ Directional arrow: Bốn hướng mũi tên bao quanh phím ENTER, mũi tên trái được
sử dụng để di chuyển từ trường đến trường, không phải trong một trường. Các mũi tên lên
và xuống được sử dụng để di chuyển con trỏ từ dòng sang dòng trong hộp lựa chọn, hoặc
đến một dòng kế tiếp khi chỉnh sửa hoặc tạo ra các protocol mới.
+ ENTER: Ở giữa các phím mũi tên là phím ENTER. Khi nhấn ENTER, lựa chọn hiện
tại được chấp nhận
+ STOP: Phía dưới và bên trái của ENTER và các phím mũi tên là STOP. Nếu phím
STOP được nhấn trong khi protocol đang được thực hiện, thì nó sẽ được tạm dừng
b) Bộ vi xử lý: Có nhiệm vụ: Ghi nhớ các chương trình đã cài đặt vào máy, thực hiện các
lệnh đến module phản ứng, ghi nhận cách thay đổi nhiệt độ buồng ủ PCR trong các chu kỳ
nhiệt để điều chỉnh cho đúng với chương trình đang được thực hiện
c) Buồng phản ứng
- Là nơi mà các chu kỳ nhiệt được thực hiện qua sự điều khiển của bộ vi xử lý. Module
phản ứng có thể thích ứng với 96 giếng × 0,2 mL, 48 giếng × 0,2 mL, 60 giếng × 0,5 mL,
hoặc 384 giếng × 0,5 mL.
- Sealing ring (vịng đệm kín): tối ưu hóa việc cách nhiệt của block phản ứng, sealing
ring được dùng với iCycler module 96 × 0,2 mL và module 60 × 0,5 mL.
- Sealing ring có tác dụng ngăn chặn sự biến dạng của ống và hạn chế sự ngưng tụ gây
ra do môi trường ẩm ướt hoặc khi giữ trong nhiều giờ ở 4oC.
- Trong các chu kỳ nhiệt, nhiệt độ ở module phản ứng có thể tăng lên cao hay hạ xuống
thấp trong một thời gian rất ngắn.
- Ðể làm thay đổi được nhiệt độ trong module phản ứng, có 2 phương pháp: 1) liên tục
thổi lên buồng ủ những luồng khí nóng sinh ra từ một đèn phát nhiệt, hay luồng khí lạnh
sinh ra từ một dàn lạnh của máy làm lạnh. 2) hoạt động dựa theo hiệu ứng Peltier ngược.
d) Mặt sau của máy
Ngoài các kết nối cáp điện, bảng điều khiển phía sau của iCycler chứa kết nối cho các
thiết bị sau đây:
- Cổng nối tiếp: Dùng để kết nối một máy tính PC với iCycler. Điều này cho phép tải
các báo cáo KQ vào máy tính. Cáp nối tiếp được che chắn, hỗ trợ chuyển giao và tiếp đất.
- Cổng song song: Dùng để kết nối một máy in tương thích với PC-iCycler, cho phép in
báo cáo KQ được xác nhận. Cáp tương thích là IEEE 1284/Centronics và được che chắn.
- Khuyến cáo: Nếu có sử dụng máy in thì máy in phải được tắt trước máy iCycler
Câu 2.4: Tính năng và thơng số kỹ thuật của máy PCR Icycler (Bio-Rad).
a) Tính năng
- Mơ tả đồ họa của protocol thông qua các ngôn ngữ chuẩn.
- Phần mềm thân thiện với người dùng, bao gồm menu điều khiển phần mềm, các mẫu
protocol có sẵn, và các dạng tập tin (file) quen thuộc.
- Module phản ứng PCR (buồng ủ) có thể thay đổi.
- Tính linh hoạt về số lượng mẫu tối đa: module phản ứng PCR có thể thích ứng với
tube 0,2 mL, các thanh và đĩa 96 giếng, tube 0,5 mL, và đĩa 384 giếng.
- Việc kiểm soát và điều khiển nhiệt độ có thể được ghi bởi thuật tốn cơng cụ, đầu dị
mẫu, hoặc kiểu buồng ủ phản ứng.
- Tính năng bảo vệ tùy chọn cho từng loại protocol và folder (thư mục).
- Máy sử dụng hệ thống điều khiển nhiệt độ bằng kỹ thuật Peltier. Có các chức năng
kiểm soát: gradient, gia nhiệt, tốc độ gia nhiệt, thời gian làm việc… Đặc biệt chức năng
gradient cho phép tối ưu q trình thí nghiệm trong thời gian ngắn.
- Thiết bị gọn, nhẹ, tiết kiệm diện tích, thuận tiện cho người sử dụng với việc dễ dàng
thiết lập và gọi ra chương trình làm việc, chế độ tự chuẩn máy, buồng ủ nhiệt ở nắp giúp
mẫu không bị bay hơi vì thế khơng cần dùng dầu khống (mineral oil) cho mẫu chạy PCR
b) Thông số kỹ thuật
- Nguồn điện vào
100-120 VAC:
100-120 VAC, ±10%, 50-60 Hz
Fuse: 8.0 A, 5×20 mm, Type T
220-240 VAC:
220-240 VAC, ±10%, 50-60 Hz
Fuse: 4.0 A, 5×20 mm, Type T
Nguồn:
670 Watts, 910 VA (max.)
200 Watts (typical)
- Nhiệt độ (khung)
Hoạt động: 5-32oC
Bảo quản (xung quanh): -20oC đến 60oC
- Nhiệt độ (buồng ủ): cho các module 96 và 384 giếng.
Dải nhiệt độ làm việc: 4-100oC
Độ chính xác nhiệt: ±0,3oC sau 30 sec ở 90oC (kiểu block)
Độ đồng nhất nhiệt (well-to-well): ±0,4oC trong 30 sec sau khi đạt đến 90oC.
- Gradient nhiệt: cho module 96 giếng (0,2 mL).
Dải gradient đầu vào: 1-25oC
Dải gradient chức năng: 5-25oC
Nhiệt độ gradient tối thiểu: 40oC
Nhiệt độ gradient tối đa: 99oC
Độ chính xác gradient: ±0,4oC
Độ đồng nhất gradient: ±0,4oC
- Nhiệt độ của nắp: 105oC
- Độ ẩm môi trường làm việc: không hoạt động ở độ ẩm >90%
Câu 2.5: Nguyên lý của kỹ thuật real-time PCR
- Real-time PCR cho phép phát hiện và định lượng sản phẩm DNA dánh dấu huỳnh
quang được khuếch đại khi tiến trình phản ứng đang diễn ra nhờ một module phát hiện tín
hiệu huỳnh quang, trong đó tín hiệu huỳnh quang đo được phản ánh số lượng sản phẩm
DNA được khuếch đại trong mỗi chu kỳ
- Ưu điểm của real-time PCR:
+ Cho phép chúng ta định lượng số bản sao khởi đầu của khn mẫu với độ chính xác
và độ nhạy cao.
+ Số liệu của real-time PCR có thể đánh giá mà khơng cần điện di gel, nhờ đó thời gian
thí nghiệm được rút ngắn.
+ Do các phản ứng được chạy và số liệu được đánh giá trong một hệ thống tube đóng
kín, nên các cơ hội nhiễm bẩn được giảm thiểu và sự cần thiết của các thao tác hậu khuếch
đại được loại bỏ.
- Trong real-time PCR, người ta thường sử dụng các loại thuốc nhuộm liên kết DNA sợi
đôi như SYBR Green để phát huỳnh quang, và các probe hoặc primer đặc hiệu chuỗi được
đánh dấu huỳnh quang như Taqman PCR, Beacon probe và Scorpion.
- Thuốc nhuộm khi chèn vào DNA sợi đôi sẽ phát huỳnh quang mạnh hơn ở trạng thái
tự do, ethidium bromide sáng gấp 25 lần, SYBR Green sáng gấp 200 lần.
- SYBR Green: Các phân tử thuốc nhuộm sẽ gắn với các DNA sợi đôi, nhờ vậy khi
chiếu ánh sáng kích thích chúng ta có thể đo được các tín hiệu huỳnh quang phát ra ở giai
đoạn kéo dài
- Các probe đặc hiệu có gắn chất phát huỳnh quang sẽ phát sáng khi bắt cặp với trình tự
đích và khơng phát sáng khi tự do. Có 3 dạng probe phát huỳnh quang chính:
+ Probe phân cắt: Taqman
+ Probe có thể tách rời: Beacon, FRET
+ Probe gắn trực tiếp với primer: Ampliflour, Scorpion
Câu 2.6: Nguyên lý đọc trình tự DNA theo phương pháp enzyme của Sanger.
Phương pháp enzyme được Sanger và cộng sự phát minh cũng vào năm 1977, và ngày
nay phương pháp này càng ngày càng được hoàn thiện và thực hiện dễ dàng tại các phịng
thí nghiệm. Ngun tắc chung của phương pháp này có thể tóm tắt như sau
- Trước tiên, chèn đoạn DNA cần xác định trình tự vào một vector là phage hay plasmid
tại một vị trí đã được xác định rõ.
- Biến nạp các vector mang đoạn chèn DNA này vào tế bào vi khuẩn để nhân thành
nhiều bản sao, sau đó tách chiết và tinh sạch chúng.
- Dùng các primer bổ sung đặc hiệu với trình tự của vector tại vị trí chèn đoạn DNA.
Thêm vào tube phản ứng DNA polymerase và 4 loại nucleotide tự do (dNTP) và một
lượng rất hạn chế các nucleotide kết thúc là dideoxynucleotide triphosphate (ddNTP)
tương tự như dNTP nhưng đầu 3’ khơng có nhóm OH.
- Phản ứng được thực hiện trong 4 ống, và mỗi ống cho một loại ddNTP khác nhau.
Bắt đầu từ đoạn mồi, DNA polymerase sẽ kéo các dNTP vào để tổng hợp mạch đơn bổ
sung với mạch DNA chèn trên vector, và sự tổng hợp mạch đơn sẽ bị dừng lại tại vị trí mà
ddNTP được kéo vào thay vì dNTP. Lý do sự tổng hợp bị dừng lại là vì ddNTP có cấu
trúc hóa học bị mất đi gốc OH tại vị trí carbon thứ 3 của đường deoxyribose, mà gốc OH
tại vị trí này chính là nơi để dNTP kế tiếp được gắn vào (liên kết phosphodiester). Nhờ đó,
trong ống phản ứng có các mạch đơn DNA có các chiều dài khác nhau tương ứng với các
trình tự nucleotide trên đoạn DNA gốc.
- Để đọc trình tự, người ta dùng phương pháp điện di trên gel polyacrylamide biến tính.
Với phương pháp đánh dấu primer hay các ddNTP bằng đồng vị phóng xạ 32P hay 35S thì
sau khi điện di, cũng giống như phương pháp của Maxam và Gilbert, có thể phát hiện các
vạch điện di (băng DNA) bằng kỹ thuật phóng xạ tự ghi, và từ các vạch này xác định được
trình tự của đoạn DNA chèn vào vector
Câu 2.7: Nguyên lý đọc trình tự DNA theo phương pháp enzyme nhờ hỗ trợ của
máy tính.
- Các phịng thí nghiệm hiện nay đều đọc trình tự bằng phương pháp enzyme, nhưng
thường dùng các máy tự động chứ khơng dùng kỹ thuật phóng xạ tự ghi như trước đây. Để
đọc trình tự bằng cách này thì các mạch đơn DNA sinh ra trong ống nghiệm phản ứng
phải được đánh dấu huỳnh quang để các vạch điện di của các mạch đơn DNA này phát
sáng khi đi qua một chùm tia laser. Cấu tạo của một máy đọc trình tự DNA tự động gồm
hai phần chính: phần điện di với polyacrylamide gel và phần phát hiện các vạch điện di.
- Phần điện di polyacrylamide có thể là một bản gel hay là một ống mao quản chứa gel.
- Phần phát hiện vạch điện di là những con mắt cảm quang và một chùm tia laser đi qua
trước nó.
- Nguyên tắc hoạt động của máy là trong suốt q trình điện di, mỗi khi có một vạch
điện di đi qua chùm tia laser thì vạch điện di sẽ phát sáng lên và sự phát sáng này sẽ được
con mắt cảm quang ghi nhận và lưu lại thành một đỉnh cường độ sáng trong biểu đồ. Từ
biểu đồ của các đỉnh cường độ sáng này, máy sẽ so dòng của các đỉnh tương ứng với các
màu để cuối cùng phân tích thành trình tự của một đoạn DNA
- Với các máy thế hệ mới sau này người ta dùng 4 màu huỳnh quang khác nhau để
đánh dấu 4 loại ddNTP, nhờ vậy phản ứng đọc trình tự có thể chỉ thực hiện được trong 1
ống nghiệm và khi đọc trình tự chỉ cần điện di trên một đường mà không cần phải trên 4
đường khác nhau như trước đây
- Nếu dùng diện di mao quản thì tùy thuộc vào số mao quản có thể chạy trong một lần
mà đọc được trình tự DNA của số mẫu tương ứng.
- Tùy thuộc vào qui mơ của phịng thí nghiệm cùng với số mẫu cần đọc trình tự, có thể
trang bị máy có ít hay nhiều mao quản. Ví dụ, máy ABI có nhiều loại: 1, 4, 16, 48, và 96
mao quản.
Câu 2.8: Cấu tạo của máy đọc trình tự gen ABI 3130 (Applied Biosystems).
a) Hệ mao quản
- Hệ mao quản được làm từ chất liệu thủy tinh, thạch anh hoặc là silicon. Đường kính
trong của mao quản 50 µm.
- Hệ mao quản ra đời thay thế cho bản gel có nhiều ưu điểm hơn. Mao quản cho khả
năng phân tách tốt hơn, có thể thay đổi kích thước tùy ý, 1 mao quản có thể thực hiện
được khoảng 150 phản ứng đọc trình tự thay vì một lần đọc như của bản gel, để tăng hiệu
suất làm việc và giảm thiểu tối đa thời gian cho quá trình này nhà sản xuất đã khơng
ngừng cải tiến hệ mao quản.
- ABI có các loại mao quản chiều dài khác nhau:
+ 22 cm dùng phân tích đa hình và các đoạn DNA ngắn có mức độ lặp lại cao.
+ 36 cm dùng phân tích trình tự lặp lại và đa hình các trình tự.
+ 50 cm kiểu mao quản chuẩn thường hay được sử dụng.
+ 80 cm dùng để phân tích các đoạn gen có trình tự dài
b) Bơm polymer và đệm
- Sử dụng bộ phận cấp polymer tự động cho phép bơm trực tiếp polymer vào mao quản
trước mỗi phản ứng đọc trình tự và đệm được bơm vào mao quản sau khi phản ứng xong
để rửa sạch mao quản và bơm polymer cho phản ứng sau.
- Polymer sử dụng trong phản ứng đọc trình tự là polyacryamide ở các nồng độ khác
nhau mà ta có các loại POP 4, 6 và 7.
- Tùy thuộc vào đặc điểm của các thành phần phản ứng có thể sử dụng các loại gel
polyacrylamide khác nhau.
- Đối với các trình tự ngắn và chiều dài mao quản ngắn cần phải tăng nồng độ gel để
đảm bảo các trình tự được tách hồn tồn trước khi ra khỏi mao quản, cịn các trình tự dài
và mao quản dài có thể sử dụng gel nồng độ thấp để dễ phân tách
c) Detector
- Là bộ phận cốt yếu của hệ thống có khả năng nhận tín hiệu huỳnh quang để phát hiện
các trình tự DNA.
- Các đoạn DNA được khuếch đại với các dNTP và ddNTP có thuốc nhuộm huỳnh
quang sẽ có độ dài hơn kém nhau một nucleotide. Trong quá trình điện di các đoạn này sẽ
phân tách khỏi nhau và đi qua mao quản với thời gian khác nhau.
- Các đoạn có kích thước ngắn sẽ ra trước và nhờ tín hiệu huỳnh quang phát ra từ thuốc
nhuộm mà detector phát hiện và ghi lại kết quả bằng các peak trên màn hình máy tính của
hệ thống.
- Thơng thường, người ta sử dụng 4 loại thuốc nhuộm cho 4 loại ddNTP (Hình 5.11)
khác nhau nhờ vậy có thể phân biệt và xử lý dữ liệu một cách dễ dàng
d) Bộ phận cấp mẫu
- Thường có 2 loại: 96 giếng và 384 giếng.
- Bộ phận này cấp mẫu hoạt động hoàn toàn tự động thông qua hệ thống định vị 3 chiều
(xyz), khay sẽ dịch chuyển và cung cấp mẫu cho mao quản. Thông thường, hệ thống 4
mao quản sẽ dịch chuyển theo hình sin để cấp mẫu, loại 16 mao quản thì dịch chuyển tịnh
tiến, mỗi lần dịch chuyển 2 hàng để nạp đủ mẫu cho cả 16 mao quản
Câu 2.9: Tính năng kỹ thuật và tiện ích của máy đọc trình tự gen ABI 3130
(Applied Biosystems)
a) Tính năng kỹ thuật
- Thiết kế linh hoạt với công suất 4 mao quản (3130) dễ dàng nâng cấp lên 16 mao quản
(3130xl).
- Thời gian hoạt động liên tục trong 24 giờ.
- Tự động hoàn toàn với hệ thống bơm polymer cùng bộ phận nạp mẫu tự động.
- Mao quản có đường kính trong 50 µm, làm giảm tối đa tín hiệu nhiễu.
- Sử dụng performance optimized polymer (POP) cho quá trình điện di phân tách.
- Sử dụng 1 loại POP và 1 loại mao quản cho tất cả các ứng dụng về phân tích trình tự
và phân tích phân đoạn.
- Cung cấp mao quản với các size khác nhau và các loại POP khác nhau để có thể tối ưu
cho từng ứng dụng chuyên biệt. Điều đó giúp đọc được đoạn gen có chiều dài >1000 base,
đồng thời cũng giúp phân tích SNP (single nucleotide polymorphism) chỉ trong 15 phút.
- Cung cấp đầy đủ các loại phần mềm chuyên dụng để có thể triển khai tất cả các ứng
dụng, trong tất cả các lĩnh vực và đối tượng: chẩn đoán, nghiên cứu phát hiện mới, xây
dựng ngân hàng gen, giám định hình sự, đa dạng kiểu gen và đa dạng di truyền.
- Tóm lại: ABI 3130 là hệ thống tiên tiến hiện nay, cho phép tự động hoàn toàn từ khâu
đưa polymer lên mao quản đến phân tích. Hệ thống có đầy đủ các ứng dụng: phân tích
microsatellite, SNP, AFLP, và LOH
b) Tiện ích của hệ thống
- Cài đặt tối thiểu và hoạt động đơn giản, hệ thống cung cấp polymer tự động nhờ đó
khơng cần phải tự nhồi gel vào xylanh, bảo quản và rửa sạch mao quản sau khi chạy.
- Bộ cấp nhiệt cho buồng đọc (detection cell heater) và các module được tối ưu 3130
POP-7™ tạo nên dữ liệu ổn định có chất lượng cao giúp mở rộng ứng dụng trong phân
tích trình tự và phân tích phân đoạn với thời gian làm việc nhanh hơn.
- Công nghệ mạnh và giảm thiểu thực sự yêu cầu bảo quản.
- Tăng chất lượng của dữ liệu phân tích trình tự và các ứng dụng phân tích phân đoạn,
chiều dài của đoạn DNA được phân tích tăng lên, khả năng xử lý tăng lên và thời gian
chạy ngắn hơn do có nhiều sự lựa chọn cho các ứng dụng.
- Mở rộng chức năng one-polymer và one-array đối với cả việc đọc trình tự và các ƯD
phân tích phân đoạn, chuyển đổi liền mạch giữa phân tích trình tự và phân tích phân đoạn.
- Hệ thống cung cấp polymer, nạp mẫu, phân tách, đọc và phân tích dữ liệu hồn tồn tự
động trong vịng 24 giờ.
- Cải tiến của toàn bộ hệ thống nhằm giúp dễ dàng sử dụng, khơng cần phải là một
chun gia mới có được một kết quả tốt.
- Hệ thống ABI 3130 được nâng cấp với 2 chương trình phân tích DT mới nhất. Cho dù
phân tích trình tự, phân tích phân đoạn hay cả hai, đều có phần mềm xử lý đáp ứng.
- Hệ thống xác định trình tự DNA tự động sử dụng kỹ thuật huỳnh quang đa màu và
phân tách trên cột mao quản.
- Sử dụng nhiều loại POP chuyên biệt và mao quản với chiều dài khác nhau cho từng
yêu cầu ứng dụng cụ thể.
- Thời gian chạy trong 15 phút cho 16 mẫu (3130xl) hoặc 4 mẫu (3130).
Câu 2.10: Các phần mềm phân tích dữ liệu trên máy đọc trình tự gen ABI 3130
(Applied Biosystems).
1. Sequencing Analysis Software
- Thực hiện basecalling (chuyển tín hiệu màu của điện di thành các nucleotide tương
ứng). Với basecaller KB có thể:
+ Xác định độ tinh khiết và pha trộn các nucleotide.
+ Gán một giá trị chất lượng cho từng nucleotide.
+ Phát hiện phân tích thất bại.
+ Tính tốn giá trị chất lượng (QV) cho mỗi nucleotide.
- Phân tích lại dữ liệu bằng cách sửa đổi các thiết lập phân tích.
- Tổng quan dữ liệu cho xử lý sự cố bằng cách sử dụng các số liệu được cung cấp.
- Xuất ra các định dạng phân tích trình tự bao gồm *.seq, *.phd1 và *.scf để tích hợp
với các cơng đoạn phân tích về sau.
- Tạo ra đường dẫn để theo dõi thay đổi các nucleotide và thiết lập phân tích.
2. Variant Reporter™ Software
- Phân tích dữ liệu trình tự và tạo ra một trình tự duy nhất chính xác cho mỗi mẫu.
- Ghi nhận và chỉnh sửa bằng cách sử dụng các thuật toán nâng cao chất lượng và số
liệu bổ sung trong KB ™ v1.4 Basecaller.
- Sắp gióng cột trình tự để xác định các biến thể.
- Nhập vào các trình tự tham khảo trên Genbank (NCBI).
- Tùy chỉnh trình tự tham khảo bằng cách tạo ra các trình tự duy nhất bao gồm các đặc
tính khác nhau, như exons, introns, và các vùng không dịch mã (UTRs).
- Thiết lập số liệu kiểm soát chất lượng để lọc ra dữ liệu chất lượng thấp, đảm bảo kết
quả tin cậy cao hơn và giảm thời gian xem xét hướng dẫn sử dụng.
- Lưu trữ các dự án với các tập tin mẫu và tất cả các dữ liệu tham khảo liên quan (các
thiết lập phân tích, tài liệu tham khảo…) cho mục đích chia sẻ dữ liệu.
3. SeqScape® Software
- Phân tích dữ liệu trình tự và tạo ra một trình tự duy nhất chính xác cho mỗi mẫu.
- Ghi nhận nucleotide bằng cách sử dụng các thuật toán nâng cao chất lượng và số liệu
bổ sung trong KB ™ Basecaller.
- Nhập vào các trình tự tham khảo trên Genbank (NCBI).
- So sánh dữ liệu trình tự được phân tích với trình tự tham khảo để xác định các biến thể
được biết đến hoặc một thư viện của các trình tự liên quan.
- Hiển thị các biến thể amino acid trong trình tự liên quan.
4. MicroSeq® ID Analysis Software
- So sánh các dữ liệu trình tự của lồi vi khuẩn hoặc nấm chưa được biết đến với trình
tự của các vi khuẩn hoặc nấm đã biết được lưu trữ trong thư viện.
- Tạo một danh sách cuối cùng của các loài sinh vật có chỉ số họ hàng mà chưa từng
biết đến, dựa trên sự phản ánh phần trăm tương đồng có chỉ số họ hàng trong thư viện
trình tự.
5. Sequence Scanner Software
- Xem, chỉnh sửa, in ấn, xuất ra các định dạng dữ liệu trình tự.
- Sắp xếp phân tích các peak.
- Lập bản đồ các vết trên vị trí đĩa tương ứng để hình dung mơ hình chất lượng.
- Tạo ra và xuất các báo cáo đồ họa.
- Xuất dữ liệu trình tự vào tập tin định dạng bao gồm *.fsta, *.seq, *.phd1 và *.scf.
Câu 3.1: Cấu tạo và nguyên lý hoạt động của súng bắn gen PDS-1000/He.
a) Cấu tạo
- Thiết bị bao gồm:
+ Thân máy chính
+ Nguồn khí He
+ Bộ điều áp khí He
+ Bộ nguồn chân không
+ Van solenoid
+ Hệ thống các ống nối
+ Các dụng cụ
- Sơ đồ cấu tạo
b) Nguyên lý hoạt động
- Súng bắn gen Biolistic PDS-1000/He System hay hệ thống dội bom của Hãng BioRad sử dụng áp lực cao của khí He, được giải phóng bởi đĩa an tồn (RD), và một phần
chân khơng để đẩy một tấm macrocarrier (viên đạn lớn) được gắn hàng triệu vi đạn bằng
vàng hoặc tungsten có kích thước hiển vi đến các tế bào đích với vận tốc cao. Những vi
đạn này được bọc DNA hoặc là các vật liệu sinh học khác để biến nạp. Macrocarrier sẽ
dừng lại sau khi di chuyển một quãng ngắn do bị một tấm lưới chặn. Các vi đạn được bọc
DNA tiếp tục di chuyển hướng đến tế bào đích để xuyên qua và biến nạp vào tế bào
- Tốc độ khởi đầu của các vi đạn của mỗi súng bắn gen phụ thuộc vào áp suất khí He,
hàm lượng chân khơng của buồng dội bom, khoảng cách từ RD đến macrocarrier, khoảng
cách di chuyển của macrocarrier đến tấm lưới chắn, và khoảng cách giữa tấm lưới chắn và
các tế bào đích. Các yếu tố quan trọng nhất có thể tối ưu trong hệ thống dội bom là
khoảng cách đến đích và kích thước của vi đạn. Các thông số khác cần được tối ưu theo
kinh nghiệm.
Câu 3.2: Cấu tạo và nguyên lý hoạt động của máy chuyển gen bằng xung điện
Gene Pulser Xcell (Bio-Rad)
a) Cấu tạo
Hệ thống bao gồm:
- 1 thân máy chính
- 2 module phụ (CE Module và PC Module)
- Buồng sốc điện
- 1 cuvette có chứa điện cực
b) Nguyên lý hoạt động
- Gene Pulser Xcell của Hãng Bio-Rad là một loại máy phát xung điện sử dụng các tụ
điện tạo ra xung kim hoặc xung vuông để chuyển gen vào các tế bào. Bộ phận này có thể