de kiem tra hoc ki 2 mon hoa 8 co ma tran
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (87.41 KB, 5 trang )
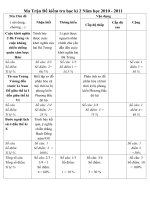
<span class='text_page_counter'>(1)</span>PHÒNG GD- ĐT BỐ TR ẠCH. TRƯỜNG TH-THCS HƯNG TRẠCH. ĐỀ KIỂM TRA HỌC KỲ II NĂM HỌC: 2012-2013. MA TRẬN ĐỀ KIỂM TRA HỌC KÌ II MÔN HÓA HỌC LỚP 8 Nội dung kiến thức. Nhận biết. 1.Phân Câu 1 loại, gọi 1,0 điểm tên các hợp chất 2. Hiđro, nước, các phản ứng hóa học.. Thông hiểu 2,0 điểm. 2 câu 4,0 điểm 40%. 1,0 điểm. 2 câu 2,0 điẻm 20%. Câu 2 2,0 điểm. 3. Dung dịch, bài tập định lượng Số câu Số điểm Tỉ lệ. Mức độ kiến thức Vận dụng Vận dụng Tổng cộng thấp cao. Câu 3. 2câu 3,0 30%. 2 câu 3,0 30%. 2,5 điểm. 1,5 điểm. 1 câu 2,5 25%. 1 câu 1,5 15%. 2 câu 4,0 điểm 40% 6 câu 10 100%.
<span class='text_page_counter'>(2)</span> ĐỀ I: Câu 1 (3 đ). Em hãy phân loại và gọi tên các hợp chất sau: CaSO4 ; NaHCO3 ; Fe(OH)3 ; HBr ; CuO; SO2 ; H2SO4 ; KOH Câu 2 (3 đ): Em hãy điền các chất thích hợp và lập phương trình các phản ứng sau, cho biết các phản ứng thuộc phản ứng nào đã học. a) Zn + ......... H2 + ……. 0 b) KMnO4 t ……. + O2 + ……. c) ……. + H2O HNO3 0 d) CaCO3 t …… + …… Câu 3 (4 đ): Cho kẽm dư tác dụng với 200 ml dung dịch axit clohiđric 1M, thu được V (lít) khí hiđro (đktc). a) Viết phương trình phản ứng b) Tính khối lượng kẽm đã phản ứng và thể tích khí hiđro thu được c) Tính nồng độ phần trăm của dung dịch sau phản ứng, biết DHCl =1,1 (g/ml). ĐỀ II: Câu 1 (3 đ). Em hãy phân loại và gọi tên các hợp chất sau: CaCO3 ; Ca(HSO4)2 ; Ba(OH)2 ; HCl ; Al2O3; SO2 ; H3PO4 ; Al(OH)3 Câu 2 (3 đ): Em hãy điền các chất thích hợp và lập phương trình các phản ứng sau, cho biết các phản ứng thuộc phản ứng nào đã học. a) …….. + HCl H2 + ……. 0 b) KClO3 t ……. + ……. c) ……. + H2O H2SO4 0 d) …… + …… t H2O Câu 3 (4 đ): Cho sắt dư tác dụng với 100 ml dung dịch axit clohiđric 2M, thu được V (lít) khí hiđro (đktc). a) Viết phương trình phản ứng b) Tính khối lượng sắt đã phản ứng và thể tích khí hiđro thu được c) Tính nồng độ phần trăm của dung dịch sau phản ứng, biết DHCl =1,1 (g/ml).
<span class='text_page_counter'>(3)</span> ĐÁP ÁN ĐỀ THI HỌC KÌ II MÔN HÓA HỌC LỚP 8 ĐỀ II: Đáp án Câu 1: Nếu sai một hợp chất thì được nửa số điểm. - Muối: CaCO3 và Ca(HSO4)2 + CaCO3 : Canxi cacbonat ; Ca(HSO4)2 : Canxi hiđrosunfat - Oxit: SO2 và Al2O3 + SO2 : Lưu huỳnh đioxit ; Al2O3 : Nhôm oxit - Axit: HCl và H3PO4 + HCl : axit Clohiđric ; H3PO4 : axit photphoric - Bazơ : Ba(OH)2 và Al(OH)3 + Ba(OH)2 : Bari hiđroxit ; Al(OH)3 : Nhôm hiđroxit Câu 2: a) Zn + 2 HCl H2 + ZnCl2 Phản ứng thế b) 2KClO3 t0 2 KCl + 3 O2 Phản ứng phân huỷ c) SO3 + H2O H2SO4 Phản ứng hóa hợp d) 2H2 + O2 t0 2H2O Phản ứng hóa hợp Câu 3: a) Phương trình phản ứng : Fe + 2 HCl FeCl2 + H2 b) Ta có: nHCl CM .V 2.0,1 0, 2(mol ) 1 nFe nH 2 nFeCl2 nHCl 0,1(mol ) 2 Theo ptpư ta có: Vậy: mFe 0,1.56 5, 6( g ) VH 2 0,1.22, 4 2, 24(l ). c) Khối lượng dung dịch HCl là = D.V =1,1 . 200 =220 (g) Khối lượng dung dịch sau phản ứng là khối lượng của FeCl2. Áp dụng định luật bảo toàn khối lượng ta có: mdd mHCl mFe mH 2 220 5, 6 (0,1.2) 225, 4( g ). Mà mFeCl 0,1.136 12, 7( g ) Nồng độ phần trăm của dung dịch thu được là: 2. C% . 12, 7 .100% 5, 63% 225, 4. Biếu điểm 0,25 0,5 0,25 0,5 0,25 0,5 0,25 0,5 0,5 0,25 0,5 0,25 0,5 0,25 0,5 0,25. 0,5 0,5 0,5 0,5 0,5 0,25. 0,5 0,25 0,5.
<span class='text_page_counter'>(4)</span> ĐÁP ÁN ĐỀ THI HỌC KÌ II MÔN HÓA HỌC LỚP 8 ĐỀ I:. Đáp án Câu 1: Nếu sai một hợp chất thì được nửa số điểm. - Muối: CaSO4 và NaHCO3 + CaSO4 : Canxi sunfat ; NaHCO3 : Natri hiđrocacbonat - Oxit: SO2 và CuO + SO2 : Lưu huỳnh đioxit ; CuO : Đồng (II) oxit - Axit: HBr và H2SO4 + HBr : axit bromhiđric ; H2SO4 : axit sunfuric - Bazơ : KOH và Fe(OH)3 + KOH : Kali hiđroxit ; Fe(OH)3 : Sắt (III) hiđroxit Câu 2: a) Zn + H2SO4 H2 + ZnSO4 Phản ứng thế b) 2KMnO4 t0 K2MnO4 + O2 + MnO2 Phản ứng phân huỷ c) N2O5 + H2O 2HNO3 Phản ứng hóa hợp d) CaCO3 t0 CaO + CO2 Phản ứng phân huỷ Câu 3: a) Phương trình phản ứng : Zn + 2 HCl ZnCl2 + H2 d) Ta có: nHCl CM .V 1.0, 2 0, 2(mol ) 1 nZn nH 2 nZnCl2 nHCl 0,1(mol ) 2 Theo ptpư ta có: Vậy: mZn 0,1.65 6,5( g ) VH 2 0,1.22, 4 2, 24(l ). e) Khối lượng dung dịch HCl là = D.V =1,1 . 200 =220 (g) Khối lượng dung dịch sau phản ứng là khối lượng của ZnCl2. Áp dụng định luật bảo toàn khối lượng ta có: mdd mHCl mZn mH 2 220 6, 5 (0,1.2) 226,3( g ) m. 0,1.136 13, 6( g ). Mà ZnCl Nồng độ phần trăm của dung dịch thu được là: C% . 2. 13, 6 .100% 6% 226,3. Biếu điểm 0,25 0,5 0,25 0,5 0,25 0,5 0,25 0,5 0,5 0,25 0,5 0,25 0,5 0,25 0,5 0,25. 0,5 0,5 0,5 0,5 0,5 0,25. 0,5 0,25 0,5.
<span class='text_page_counter'>(5)</span>
<span class='text_page_counter'>(6)</span>