12 đề kiểm tra 1 tiết lần 3 môn hóa khối 11
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (106.38 KB, 3 trang )
<span class='text_page_counter'>(1)</span><div class='page_container' data-page=1>
UBND THÀNH PHỐ ĐÀ NẴNG <b>ĐỀ KIỂM TRA 1 TIẾT</b>
<b>SỞ GIÁO DỤC VÀ ĐÀO TẠO</b>
<b>BÀI KIỂM TRA 1 TIẾT – SỐ 3</b>
<b>LĨP 11 – CHƯƠNG TRÌNH CHUẨN </b>
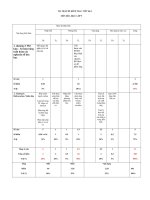
<b> Cấp độ</b>
<b>Tên chủ đề</b>
<b>Biết (1)</b>
<b>3,0</b>
<b>Hiểu (2)</b>
<b>3,0</b>
<b>Vận dụng</b> <b><sub>Cộng</sub></b>
<b>Cấp độ thấp</b>
<b>(3)</b>
<b>2,5</b>
<b>Cấp độ cao (4)</b>
<b>1,5</b>
<b>Chủ đề 1</b>
đồng phân
danh pháp
Đặc điểm cấu
trúc phân tử
<b>Số câu</b> <b>0</b> <b>0</b> <b>0</b> <b>0</b> <b>0</b>
<b>Số điểm</b> <b>0</b> <b>0</b> <b>0</b> <b>0</b> <b>0</b>
<b>Tỉ lệ %</b> <b>0</b> <b>0</b> <b>0</b> <b>0</b> <b>0</b>
<b>Chủ đề 2</b>
Tính chất hố
học của ankan,
anken, ankađien
ankin
<b>Câu 2:</b>
<b> Tính chất hố </b>
học ankan, anken,
ankađien, ankin
<b>Câu 4:</b>
Phản ứng trùng
hợp C2H2. Bài
toán hiệu suất
<b>Số câu</b> <b>0</b> <b>1</b> <b>1</b> <b>0</b> <b>2</b>
<b>Số điểm</b> <b>0</b> <b>2,0</b> <b>2,5</b> <b>0</b> <b>4,5</b>
<b>Tỉ lệ %</b> <b>0</b> <b>20</b> <b>25</b> <b>0</b> <b>45</b>
<b>Chủ đề 3</b>
Phương pháp
điều chế trong
phịng thí
nghiệm và trong
công nghiệp.
Ứng dụng
<b>Câu 1</b>
ứng dụng của
buta-1,3-đien
<b>Câu 3</b>
Điều chế C4H8,
C4H6, C2H2 từ
ankan tương ứng
<b>Số câu</b> <b>1</b> <b>1</b> <b>0</b> <b>0</b> <b>2</b>
<b>Số điểm</b> <b>3,0</b> <b>1,0</b> <b>0</b> <b>0</b> <b>4,0</b>
<b>Tỉ lệ %</b> <b>30</b> <b>10</b> <b>0</b> <b>0</b> <b>40</b>
<b>Chủ đề 4</b>
Câu hỏi tổng
hợp các kiến
thức liên quan
<b>Câu 5:</b>
Bài toán phản
ứng cộng H2,
Br2 của hỗn hợp
hiđrocacbon
<b>Số câu</b> <b>0</b> <b>0</b> <b>0</b> <b>1</b> <b>1</b>
<b>Số điểm</b> <b>0</b> <b>0</b> <b>0</b> <b>1,5</b> <b>1,5</b>
<b>Tỉ lệ %</b> <b>0</b> <b>0</b> <b>0</b> <b>15</b> <b>15</b>
<b>Cộng</b> <b>30</b> <b>30</b> <b>25</b> <b>15</b> <b>100</b>
</div>
<span class='text_page_counter'>(2)</span><div class='page_container' data-page=2>
<b>SỞ GIÁO DỤC VÀ ĐÀO TẠO Bài số 3 – Lớp 11 – Chương trình chuẩn</b>
<b>Câu 1: (3,0 điểm)</b>
<b>1. Ankađien nào được dùng làm nguyên liệu sản xuất lốp xe, nhựa trám thuyền? </b>
<b>2. Hãy nêu ít nhất 4 ứng dụng của anken? </b>
<b>3. Anken không có trong thành phần dầu mỏ. Người ta dùng phản ứng nào để sản xuất anken?</b>
Viết phương trình hóa học để minh họa?
<b>Câu 2: (2,0 điểm)</b>
Hồn thành phương trình hóa học của các phản ứng hóa học sau (nếu có phản ứng xảy ra và chỉ
viết sản phẩm hữu cơ chính)
<b>a. CH</b>3 – CH(CH3) – CH2 – CH3 + Br2 <i>t</i>
<i>o</i>
<i>→</i>
<b>b. CH</b>3 – CH = C(CH3) – CH3 + HBr khí →
<b>c. CH</b>2 = CH – CH = CH2 + Br2 dd <i>tỉ lệ 1:1 /40</i>
<i>o<sub>C</sub></i>
<i>→</i>
<b>d. CH</b>3 – C ≡ CH + AgNO3 + NH3 →
<b>Câu 3: (1,0 điểm) </b>
Từ các ankan tương ứng, hãy viết phương trình hóa học (ghi đủ điều kiện nếu có) của phản ứng
điều chế các chất sau:
CH3 – CH = CH – CH3; CH2 = C(CH3) – CH = CH2.
<b>Câu 4: (2,5 điểm)</b>
Thực hiện trùng hợp V (m3<sub>) C</sub>
2H4 với hiệu suất 80% thu được 1 tấn chất dẻo PE có thành phần
polietilen là 98% về khối lượng.
<b>a. Viết phương trình hóa học của phản ứng trùng hợp? </b>
<b>b. Tính giá trị của V?</b>
<b>Câu 5: (1,5 điểm)</b>
Cho hỗn hợp khí X chứa 0,15 mol C2H4 , 0,1 mol C2H2 và 0,25 mol H2. Cho một ít bột Ni vào
hỗn hợp X rồi nung nóng một thời gian thu được hỗn hợp Y có tỉ khối đối với khí heli là
4,5625. Cho tồn bộ hỗn hợp Y sục vào nước brom dư. Tính số mol Br2 đã phản ứng?
</div>
<span class='text_page_counter'>(3)</span><div class='page_container' data-page=3>
<b>SỞ GIÁO DỤC VÀ ĐÀO TẠO Bài số 3 – Lớp 11 – Chương trình chuẩn</b>
<b>Câu</b> <b>Hướng dẫn chấm</b> <b>điểm</b>
<b>Câu 1: </b>
<b>(3,0 điểm)</b>
<b>1. buta-1,3-đien</b>
<b>2. như sgk</b>
<b>3. phản ứng đề hiđro hóa ankan – viết PTHH đúng</b>
1,0
0,25x4
0,5x2
<b>Câu 2: </b>
<b>(2,0 điểm)</b> a. CH3–CH(CH3)–CH2–CH3+Br2
<i>to</i>
<i>→</i> CH3–CBr(CH3)–CH2–
CH3+HBr
b.CH3 – CH = C(CH3) – CH3+HBrkhí→ CH3–CH2–CBr(CH3)–CH3
c. CH2=CH–CH=CH2+Br2 dd <i>tỉ lệ 1:1 /40</i>
<i>o<sub>C</sub></i>
<i>→</i> CH2Br–CH=CH–CH3
d. CH3 – C ≡ CH+ AgNO3 + NH3 → CH3 – C ≡ CAg + NH4NO3
0,5
0,5
0,5
0,5
<b>Câu 3: </b>
<b>(1,0 điểm)</b> CH3 – CH – CH – CH3
<i>xt , to</i>
<i>→</i> CH3 – CH = CH – CH3 + H2
CH3 – CH(CH3) – CH2 – CH3 <i>xt , t</i>
<i>o</i>
<i>→</i> CH2 = C(CH3) – CH = CH2 +
2H2
0,5
0,5
<b>Câu 4: </b>
<b>(2,5 điểm)</b> <b>a. CH</b>2 = CH2
<i>xt , to</i>
<i>→</i> (CH2 – CH2 )n
<b>b. Khối lượng polietilen = 98% . 1 (tấn) = 980 (kg)</b>
Khối lượng etilen thực tế dùng = 980 (kg) : (80%) = 1225 (kg)
Thể tích V (m3<sub>) là: </sub> 1225 .22,4
28 =¿ 980 (m3)
0,5
0,5
0,5
1,0
<b>Câu 5: </b>
<b>(1,5 điểm)</b>
Khối lượng mol trung bình hỗn hợp Y là : 4,5625 . 4 = 18,25
ĐLBTKL: mhh X = mhhY = 0,15.28 + 0,1.26 + 0,25.2 = 7,3
Số mol hỗn hợp Y là : 0,4
C2H4 + H2 → C2H6
C2H2 + H2 → C2H4 ⇒Số mol H2 pư = 0,15+0,1+0,25 – 0,4 = 0,1
C2H2 + 2H2 → C2H6
Số mol Br2 pư = 0,15.1 + 0,1 . 2 – 0,1 = 0,25 mol
</div>
<!--links-->