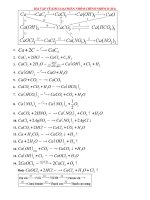CÁC NGUYÊN TỐ KIM LOẠI PHÂN NHÓM IA, IIA, IIIA
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (363.59 KB, 32 trang )
TRƯỜNG ĐẠI HỌC CÔNG NGHIỆP TPHCM
KHOA CÔNG NGHỆ HÓA
BỘ MÔN: THỰC HÀNH HÓA VÔ CƠ
BÀI 6 : CÁC NGUYÊN TỐ KIM LOẠI PHÂN NHÓM IA, IIA, IIIA
GVHD:
NGUYỄN THỊ CẨM THẠCH
SVTH: NHÓM 4
NGUYỄN THÙY GIANG
Mssv: 14127781
NGUYỄN THỊ QUỲNH NHƯ
Mssv:14124701
NGUYỄN CHÂU PHA
Mssv: 14119091
Lời cảm ơn
Em xin gửi lời cảm ơn chân thành tới cô Trần Thị Cẩm Thạch đã tạo điều
kiện,hướng dẫn tận tình để em hoàn thành tốt bài tiểu luận và cảm ơn các bạn đã
lắng nghe bài thuyết trình .Trong quá trình làm bài khó tránh khỏi sai sót rất
mong thầy cô và các bạn bỏ qua.
Xin cảm ơn
Thí nghiệm 1: tính chất hóa học của canxi
•
•
Hóa chất: Canxi kim loại, phenolphtalein
Tiến hành thí nghiệm
_ Cho nước cất khoảng 1/3 thể tích ống nghiệm. Cho một mẫu canxi kim loại
( bằng hạt đậu xanh) vào ống nghiệm.
_ Thêm vài giọt dung dich phenolphtalein vào ống nghiệm lắc đều
Thí nghiệm 1: tính chất hóa học của canxi
•
Hiện tượng
- khi cho canxi vào ống nghiệm,Ca tan dần tạo thành dung dịch có tính bazo. Có khí không màu thoát ra
miệng ống nghiệm
Phương trình phản ứng
Ca + H2O Ca(OH)2 + H2
_ khi cho vài giọt phenolphtalein vào dung dịch thì phenolphtalein sẽ chuyển sang màu hồng nhạt
Thí nghiệm 1: tính chất hóa học của canxi
•
Kết luận về tính chất của canxi
_ Canxi là kim loại kiềm thổ
_ thể hiện tính khử
_ tương tác dễ dàng với nước giải phóng khí H2
IV. Thí nghiệm 2: Tính chất hóa học của natri peroxyt Na2O2 :
•
•
Hóa chất: 1ml dd KMnO4 0,1N; 1-2ml dd Iot 0,1N; 1-2 giọt H2SO4 20%
Cách tiến hành thí nghiệm:
Lấy 2 ống nghiệm:
Ống 1: chứa 1ml dd KMnO 4 0,1N, thêm 1-2 giọt H2SO4 20%.
Ống 2: chứa 1-2ml dd Iot 0,1N, thêm 1-2 giọt H 2SO4 20%.
Thêm vào mỗi ống nghiệm một ít tinh thể Na2O2.
•
IV.TN2. Tính chất hóa học của natri peroxyt.
Hiện tượng:
Ống 1: dung dịch KMnO4 bị mất màu, sủi bọt khí.
Ống 2: dung dịch Iot nhạt màu dần sủi bọt khí.
•
Phương trình:
Ống 1:
7Na2O2 +2KMnO4 +10H2SO4 = 2MnSO4+ 7Na2SO4 +K2SO4 + 6O2 +10H2O
Ống 2:
2Na2O2 + I2 + H2SO4 = Na2SO4 + 2NaI +1/2 O2 + H2O
IV.TN2. Tính chất hóa học của natri peroxyt
Giải thích
Câu hỏi 3: mục đích thí nghiệm trên là tìm hiểu về tính chất của Na2O2 : là chất Oxh mạnh và
là chất khử yếu:
pư Na2O2 + KI + H2SO4 Na2SO4 +K2SO4 + I2 +H2O
Tính khử:
pư Na2O2 + H2SO4 + KMnO4 MnSO4 + K2SO4 + Na2SO4 + H2O + O2
câu 4: pư giữa Na2O2 với nước là phản ứng tỏa nhiệt
vì Na2O2 + H2O NaOH + O2 tỏa nhiệt
Thí nghiệm 3: muối sulfat của canxi và bari (CaSO4 và BaSO4)
•
•
Hóa chất : CaCl2 , BaCl2 0,5N ,Na2SO4, H2SO4
Tiến hành thí nghiệm
_ thêm vào từng giọt Na2SO4 bão hòa vào ống nghiệm chứa sẵn 1 ml dung dịch CaCl2 bão
hòa.
_ để yên ống nghiệm cho kết tủa lắng xuống, gạn kết tủa. Cho thêm từng giọt dung dịch
H2SO4 đậm đặc.
_ lập lại thí nghiệm trên nhưng với BaCl2 0,5N
Thí nghiệm 3: muối sulfat ( CaSO 4 và BaSO4)
•
•
Hiện tượng
Ống chứa dung dịch CaCl2 bị vẩn đục
Phương trình phản ứng
CaCl2 + Na2SO4 CaSO4 + 2NaCl
•
Ống chứa dung dịch BaCl2 bị vẩn đục nhiều hơn
Phương trình phản ứng
BaCl2 + Na2SO4 BaSO4 + 2NaCl
•
Khi cho thêm H2SO4 vào thì kết tủa không tan ở cả 2 ống nghiệm
Còn CaSO4 tan ít trong nước còn BaSO4 không tan.
Thí nghiệm 3: muối sulfat của canxi và bari
•
Tính chất hóa học của muối canxi, muối bari
_ các muối halogen của Ca va Ba dễ tan trong nước. CaCl2 ở dạng khan là khối trắng hút ẩm mạnh, ở dạng hidrat bền
( CaCl2.6H2O), là những tinh thể trong suốt. CaCl2 được dùng làm chất hút ẩm, sấy khô, hỗn hợp làm lạnh, chất mang nhiệt
trong thiết bị lạnh
_ các muối cacbonat, sunfat của canxi và bari khó tan trong nước
_ tính tan của muối cacbonat nhỏ hơn của muối sunfat
_ riêng đối với Ba, tính tan của muối sunfat nhỏ hơn muối cacbonat nhiều
_ canxi cacbonat là chất rắn trắng, không tan trong nước, nó tạo thành những núi đá vôi tự nhiên rất lớn
_ CaCO3 có thể tan trong nước có CO2 do chúng tác dụng với nhau tạo thành canxi hydrocacbonat ( Ca(HCO3)2) dễ tan
CaCO3 + CO2 + H2O = (Ca(HCO3)2)
_ canxi sunfat là chất rắn màu trắng, kết tinh ngậm nước
Thí nghiệm 3: muối sulfat của canxi và bari
( CaSO4 và BaSO4)
•
So sánh khả năng tạo tủa của BaCl2 và CaCl2
_ Na2SO4 thực hiện phản ứng trao đổi ion với BaCl2,sinh ra BaSO4 là chất
không tan,nên ta thấy có kết tủa trắng đục.Còn phản ứng Na2SO4 với CaCl2 thì
sinh ra CaSO4,là 1 chất ít tan,nên ta sẽ không thấy rõ kết tủa
I.Thí nghiệm 4: Tính chất hóa học của magie với các axit
• Hóa chất: Bột magie, HCl 1N, H2SO4 20%, HNO3 30%
• Cách tiến hành: Thí nghiệm tiến hành trong tủ hút.
Cho lần lượt vào ba ống nghiệm 1 ml dung dịch HCl 1N, 1 ml dung dịch H 2SO4 20%, 1 ml dung dịch HNO3 30%.
Thêm vào mỗi ống một mẫu magie.
• Hiện tượng:
+ Ống chứa HCl : phản ứng xảy ra chậm, có bọt khí trên bề mặt magie.
+ Ống chứa H2SO4 : magie tan dần, có khí thoát ra trên bề mặt magie.
+ Ống chứa HNO3 : magie tan, tạo khí không màu hóa nâu trog không khí.
• Phương trình phản ứng: Mg + 2HCl => MgCl2 + H2
Mg + H2SO4 => MgSO4 + H2
3Mg + 8HNO3 => 3Mg(NO3)2 + 2NO + 4H2O
V. Thí nghiệm 5: Tính chất hóa học của Magie.
•
•
Hóa chất: 2-3 ml dung dịch NH4Cl 0,1N, một mẫu Mg kim loại.
Tiến hành thí nghiệm:
Cho vào ống nghiệm khoảng 2-3ml dung dịch NH4Cl 0,1N thêm vào một mẫu Mg
kim loại, sau đó đem đun nóng.
•
•
•
•
V. Thí nghiệm 5: tính chất hóa học của magie
Hiện tượng:
Ban đầu khi chưa đun nóng không xảy ra hiện tượng.
Khi đun nóng, trong ống nghiệm có hiện tượng sủi bọt khí và khí bay ra có mùi khai.
Phương trình phản ứng:
Mg + H2O Mg(OH)2 + H2
Mg(OH)2 + 2NH4Cl 2NH3 + H2O + MgCl2
V. Thí nghiệm 5: tính chất hóa học của magie
Cách nhận biết sản phẩm sau phản ứng
Cho quỳ ẩm vào khí thu được quỳ chuyển sang màu xanh
II. Thí nghiệm 6: Tính chất của magie hydroxit
•
•
Hóa chất: MgCl2 0,5N, NaOH 0,4N, HCl 1N, NH4Cl 0,1N, thuốc thử phenolphthalein.
Cách tiến hành: Dùng becher 100 ml chứa khoảng 10 ml dung dịch MgCl 2 0,5N, sau đó thêm từ từ vài giọt dung
dịch NaOH 0,4N cho đến khi tạo kết tủa. Thêm nước cất với thể tích tương đương. Dùng đũa thủy tinh khuấy đều.
Chia đều dung dịch vào 4 ống nghiệm.
+ Ống 1: Thêm từ từ vài giọt dung dịch HCl 1N.
+ Ống 2: Thêm từng giọt muối NH4Cl 0,1N.
+ Ống 3: Thêm từng giọt dung dịch NaOH 0,4N.
+ Ống 4: Thêm 2-3 giọt dung dịch phenolphthalein.
Quan sát hiện tượng.
•
II.Thí nghiệm 6: tính chất của Mg(OH) 2
Hiện tượng: Khi cho NaOH vào muối MgCl 2 thì xuất hiện kết tủa
trắng không tan trong nước.
Ống 1: kết tủa tan dung dịch trong suốt.
Ống 2: kết tủa tan trong dung dịch trong suốt và có mùi khai.
Ống 3: không có hiện tượng.
Ống 4: dung dịch phenolphthalein chuyển sang màu hồng.
•
Phương trình phản ứng:
2NaOH + MgCl2 => Mg(OH)2 + 2NaCl
Ống 1: Mg(OH)2 + 2HCl => MgCl2 + 2H2O
Ống 2: Mg(OH)2 +2 NH4Cl => MgCl2 + 2NH3 + 2H2O
Ống 3: không phản ứng
Ống 4: không phản ứng
VI. Thí nghiệm 7: tính chất hóa học củ kim loại nhôm.
•
•
Hóa chất: 1-2ml dung dịch HCl 1N, H2SO4 20%, HNO3 30%, nhôm hạt.
Tiến hành thí nghiệm:
Cho vào 3 ống nghiệm lần lượt mỗi ống 1-2ml dung dịch HCl 1N, H2SO4 20% và HNO3 30%.
Thêm vào mỗi ống một vài hạt nhôm ( nghiêng ống nhôm trượt theo thành ống nghiệm). Sau đó đun
nóng dung dịch.
Lặp lại thí nghiệm trên nhưng thay bằng axit đặc.
VI. Thí nghiệm 7: Tính chất hóa học của kim loại nhôm.
•
-
Với dung dịch loãng:
Để ở nhiệt độ phòng: phản ứng xảy ra chậm
+ Ống 1&3: miếng nhôm tan dần, có khí thoát ra trên bề mặt Al.
+ Ống 2: có khí không màu hóa nâu trong không khí thoát ra.
•
-
Khi đun nóng: phản ứng xảy ra mãnh liệt hơn, có khí thoát ra nhiều.
Với dung dịch đặc:
Để ở nhiệt độ phòng:
+Ống 1&2 không có hiện tượng.
+ Ống 3: tạo bọt khí.
- Khi đun nóng: phản ứng mãnh liệt, có khí thoát ra.
VI. Thí nghiệm 7: Tính chất hóa học của kim loại nhôm.
• Phương trình phản ứng:
- Với dung dịch loãng:
2Al + 3H2SO4 => Al2(SO4)3 + 3H2
Al + 4HNO3 => Al(NO3)3 + NO + 2H2O
Al + 6HCl => 2AlCl3 + 3H2
Khi đun nóng: 2NO + O2 => 2NO2
- Với dung dịch đặc:
Ống 1&2 không có phản ứng .
2Al + 6HCl => 2AlCl3 + 3H2
Khi đun nóng:
2Al + 3H2SO4 => Al2(SO4)3 + 3SO2 + H2O
Al + 6HNO3 => Al(NO3)3 + 3NO2 + 3H2O
Al + 6HCl => 2AlCl3 + 3H2
VI. Thí nghiệm 7: Tính chất hóa học của kim loại nhôm.
•
•
•
Nhôm hiddroxit là chất lưỡng tính
Al(OH)4 + HCl AlCl3 + H2O tính bazo
Al(OH)4 + NaOH + H2O Na(Al(OH)4) tính axit
III. Thí nghiệm 8: Nhôm mọc lông tơ và nhôm trong không khí
•
•
Hóa chất: lá nhôm, C2H5OH 96o , HgCl2 0,2N
Cách tiến hành: Thí nghiệm tiến hành trong tủ hút.
Dùng giấy nhám đánh sạch bề mặt hai lá nhôm, sau đó nhúng vào dung dịch C 2H5OH 96o để rửa
sạch các vết nhờn, dùng giấy thấm thấm khô.
Lá nhôm thứ nhất: Để yên ngoài không khí, sau một thời gian quan sát bề mặt lá nhôm.
Lá nhôm thứ hai: Nhỏ lên bề mặt một giọt dung dịch HgCl 2 0,2N. Sau vài phút dùng giấy thấm (có
thể sử dụng giấy lọc) thấm khô dung dịch Hg2+, để yên trong không khí.
III. Thí nghiệm 8: Nhôm mọc lông tơ và nhôm trong không khí
•
Hiện tượng:
Lá nhôm thứ nhất: để yên lá nhôm ngoài không khí thì tạo thành một lớp oxit trong suốt và bền
(alumina).
Lá nhôm thứ hai: nhỏ lên bề mặt lá nhôm một giọt dung dịch HgCl 2 0,2N, Al đẩy Hg2+ ra khỏi muối
tạo Hg làm giọt dung dịch chuyển màu xám đen.sau khi thấm khô và để ngoài không khí thấy có
một lớp long tơ mọc trên bề mặt Al
III. Thí nghiệm 8: Nhôm mọc lông tơ và nhôm trong không khí
2+
Tại chỗ nhỏ Hg , miếng Al tạo hỗn hống Hg-Al. Hỗn hống này tiếp xúc với oxi trong
không khí:
4Al-Hg + 3O2 => 2Al2O3 + 4Hg
Lớp oxit hình thành rồi bông ra Hg sinh ra lại tiếp tục kết hợp với Al tạo hỗn hống phía
trong, nó tiếp xúc và tác dụng với oxi làm lớp oxit cao dần lên tạo thành hiện tượng
nhôm mọc lông tơ.