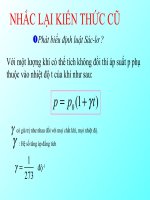Phương Trình Trạng Thái Chất Khí
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (904.57 KB, 21 trang )
Tóm tt tun1
Ü Chng 1: Mt sô khai niêm c ban – Phng
trinh trng thai cua cht khi
1.1
Các vn đ chung
1.2 Nhng khái nim c bn
1.3 Thông s trng thái ca môi cht
TUN 1
1.4 Phng trình trng thái ca cht khí
1.5 Nhit dung riêng ca cht khí
TUN 2
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.1
p.1
1.4
1.4
Phng trình trng thái ca cht khí
Phng trình trng thái ca cht khí
-Ti trng thái cân bng, thc nghim và lý thuyt cho thy:
0),,(
=
Tvpf
cho phép tìm thy thông s th 3 khi bit 2 thông s kia
1.4.1 Phng trình trng thái khí lý tng
1.4.2 Hn hp khí lý tng
1.4.3 Phng trình trng thái khí thc
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.2
p.2
1.4.1
1.4.1
Phng trình trng thái khí lý tng
Phng trình trng thái khí lý tng
Ü Khí đc xem là khí lý tng nu tha mãn 2 điu kin sau:
- Không có lc tng tác gia các phân t và nguyên t
- Không có th tích bn thân phân t
Ü Khí thc có th xem là khí lý tng điu kin áp sut khá
thp
và nhit đ khá cao
Ü Mi quan h gia các thông s p, v, T ca khí lý tng đu
tiên đc rút ra t các kt qu thc nghim
, sau đó đc chng
minh bng lý thuyt nh thuyt đng hc phân t
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.3
p.3
Ü Mô phng chuyn đng ca phân t khí
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.4
p.4
Boyle’s Law (1662)
constant (constant temperature)pV =
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.5
p.5
Charles’ Law (1776)
constant (constant pressure)
V
T
=
-273.15
o
C
t (
o
C)
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.6
p.6
Gay-Lussac’s Law (1802)
constant (constant volume)
p
T
=
t (
o
C)
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.7
p.7
Phng trình trng thái khí lý tng (Pt Clapeyron)
RTpv
=
hay:
GRTpV =
trong đó:
-p (N/m
2
):
áp sut tuyt đi ca khi khí đang xét
-v (m
3
/kg): th tích riêng ca khi khí đang xét
-V (m
3
): th tích ca khi khí đang xét
- T (
o
K): nhit đ tuyt đi ca khi khí đang xét
- G (kg): khi lng ca khi khí đang xét
-R (J/kg.đ) hng s ca cht khí đang xét
μμ
μ
8314
==
R
R
Vi μ là khi lng phân t ca 1 kmol khí
đang xét
(vd: μ caO
2
là 32 kg, caN
2
là
28 kg, vv )
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.8
p.8
Ví d 1.4: xác đnh th tích riêng ca CO
2
ti:
p = 70 bar
T = 40
o
C
Gii:
)/(4416212
2
kmolkgxCO
=
+
=
⇒
μ
(Hoc tra theo bng 1.3 [1]:
)/(01.44
2
kmolkg
CO
=
μ
S dng pt trng thái khí lý tng:
)/(00845.0
1070
)27340(955.188
3
5
kgm
x
x
p
RT
vRTpv =
+
==⇒=
đokgJR
CO
)./(955.188
44
8314
2
==
nu xem khí CO
2
điu kin trên nh
khí lý tng.
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.9
p.9
1.4.2 Hn hp khí lý tng
1
1
21
=⇒+++=
∑
=
n
i
in
gGGGG
x
x
x
o
o
o
x
x
x
o
o
o
p,V,T
p,
V
1
,T
p,
V
2
,T
1
1
21
=⇒+++=
∑
=
n
i
in
rVVVV
x
x
x
o
o
o
p,V,T
p
1
,V,T
p
2
,V,T
x
x
x
o
o
o
n
pppp
+
+
+=
21
Ü Hn hp các khí lý tng cng là khí lý tng
G
G
g
i
i
=
Ü Thành phn khi lng
V
V
r
i
i
=
Ü Thành phn th tích
Ü nh lut Gibbs-Dalton
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.10
p.10
Hng s cht khí R
hh
ca hn hp
Ü Phân t lng tng đng ca hn hp
nn
hh
ggg
μμμ
μ
/ //
1
2211
+++
=
(nu bit g
i
ca hh)
nnhh
rrr
μ
μ
μ
μ
+
+
+
=
2211
(nu bit r
i
ca hh)
Ü Hng s cht khí tng
đng
R
hh
ca hn hp
hhhh
hh
R
R
μμ
μ
8314
==
(J/kg.đ)
Ü Quan h gia r
i
và g
i
hh
ii
i
r
g
μ
μ
=
hay:
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.11
p.11
Ü Th tích riêng và khi lng riêng ca hn hp
n
n
hh
hh
hh
g
gg
G
V
v
ρρρ
+++==
2
2
1
1
(nu bit g
i
ca hh)
nn
hh
hh
hh
rrr
V
G
ρρρρ
+++==
2211
(nu bit r
i
ca hh)
Ü Phân áp sut ca các thành phn
i
hh
ihhi
gpp
μ
μ
=
nhh
pppp
+
+
+=
21
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.12
p.12
Ü Ví d 1.5 [1]
Hn hp khói thi
12.5% CO
2
4% O
2
83.5% N
2
xác đnh
v
hh
ti
p
1
= 100 kPa
T
1
= 227
o
C
(1)
ng áp
T
2
= 27
o
C
(2)
Xem hh là khí lý tng
hh
hhhh
hh
p
TR
v =
Ü Tính R
hh
:
hh
hh
R
μ
8314
=
(J/kg.đ)vi:
332211
μ
μ
μ
μ
rrr
hh
+
+
=
16.3028835.03204.044125.0
=
+
+= xxx
hh
μ
(kg/kmol)
66.275
=
hh
R
(J/kg/đ)
Ü
Th tích riêng ca hh:
(m
3
/kg)
3783.1
10100
)273227(66.275
3
)1(
=
+
=
x
x
v
hh
8270.0
10100
)27327(66.275
3
)2(
=
+
=
x
x
v
hh
(m
3
/kg)
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.13
p.13
1.4.3 Phng trình trng thái ca khí thc
Ü Có hn 200 pt trng thái ca khí thc đã đc công b, hu
nh tt c đu xut phát t thc nghim
()
TRbv
v
a
p
μμ
μ
=−
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
+
2
trong đó: - a: h s hiu chnh khi tính đn lc tng tác gia các phân t
-
b: h s hiu chnh khi k đn th tích bn thân ca phân t
Ü thun tin tính toán, t pttt ca tng loi khí thc
å BNG 1.2 [1] đ d dàng tra cu
Ü Pt Van der Waals đc thành lp(nm 1871) da trên pt
trng thái ca khí lý tng:
pt 1.34 [1]
(m
3
/kmol)
vi:
8314=
=
μ
μ
μ
R
vv
(J/kmol.đ)
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.14
p.14
Tính li VD 1.4: xác đnh th tích riêng ca CO
2
ti:
p = 70 bar
T = 40
o
C
Gii:
a) xem khí CO
2
điu kin trên nh khí lý tng.
b) xem khí CO
2
điu kin trên là khí thc, s
dng pt Van des Waals
)/(00845.0
3
kgm
p
RT
v ==
a)
S dng
pt Van des Waals:b)
()
TRbv
v
a
p
μμ
μ
=−
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
+
2
Bng 1.2 [1]
cho CO
2
:
a = 3.647 bar.(m
3
/kmol)
2
b = 0.0428 m
3
/kmol
()
()
2734083140428.0
10647.3
1070
2
5
5
+=−
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
+
μ
μ
v
v
x
x
01561.0647.3019.2970
23
=−+−
μμμ
vvv
23.0
=
μ
v
(m
3
/kmol)
005227.0
44
23.0
===
μ
μ
v
v
(m
3
/kg)
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.15
p.15
1.5 Nhit dung riêng (NDR) ca cht khí
Ü Là nhit lng cn thit cung cp cho 1 đn v cht khí tng
lên
1 đ theo mt quá trình nào đó.
Ü Phân loi:
- NDR khi lng c (kJ/kg/đ)
- NDR th tích c’ (kJ/m
3
/đ)
- NDR kmol c
μ
(kJ/kmol.đ)
'4.22 ccc
=
=
μ
μ
Ü Quan h gia các loiNDR
Ü Thng s dng nht:
c
p
, c
μp
(đng áp); c
v
, c
μv
(đng tích)
i
n
i
ihh
cgc
∑
=
=
1
vi g
i
là các thành phn khi lng ca hn hp
Ü NDR khi lng ca hn hp khí
:
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.16
p.16
Bng NDR kmol ca mt s loi khí
(kcal/kmol.đ)
Ü Note: 1 kcal = 4.186 kJ
kcal/kmol.đ
Loi khí
c
μv
c
μp
Khí
1 nguyên t 3 5 1.6
Khí 2 nguyên t (O
2
, N
2
, ) 5 7 1.4
Khí
3 và nhiu nguyên t
(CO
2
, NH
3
, …)
7 9 1.3
k = c
p
/c
v
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.17
p.17
Bng NDR kmol ca mt s loi khí
Ü VD: - Khí O
2
: c
μp
= 29.3 å c
p
= c
μp
/μ = 29.3/32 = 0.9156 kJ/kg.đ
-
Khí CO
2
:
c
μp
= 37.7 å c
p
= c
μp
/μ = 37.7/44 =
0.857 kJ/kg.đ
-
Không khí: c
p (kk)
= 0.23 c
p (O2)
+ 0.77 c
p (N2)
=
1.016 kJ/kg.đ
kJ/kmol.đ
Loi khí
c
μv
c
μp
Khí
1 nguyên t 12.6 20.9 1.6
Khí 2 nguyên t (O
2
, N
2
, ) 20.9 29.3 1.4
Khí
3 và nhiu nguyên t
(CO
2
, NH
3
, …)
29.3 37.7 1.3
k = c
p
/c
v
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.18
p.18
Tính nhit lng theo nhit dung riêng
Q = Gc (t
2
-t
1
)
trong đó: * Q (kJ): nhit lng cung cp cho quá trình
* G (kg): khi lng cht môi gii
* c (kJ/kg.đ): nhit dung riêng ca quá trình
* t
1
, t
2
(
o
C): nhit đ đu và cui ca quá trình
G
Q
t
1
t
2
-Gia nhit cho dòng môi gii đng áp
)(
12
ttGcQ
pp
−
=
Q
G
- Gia nhit cho dòng môi gii đng tích
)(
12
ttGcQ
vv
−
=
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.19
p.19
Ví d 2.4:
Q = ??
V = 300 l
không khí
p = 3 at
T
1
= 20
o
C
T
2
= 120
o
C
Không khí (21% O
2
, 79% N
2
)
2984.28
≈
=
KK
μ
(kg/kmol)
Khi lng KK cha trong bình là:
()
kg
x
xxx
RT
pV
G 05.1
)27320(
29
8314
3.010981.03
5
=
+
==
Gii:
)(
12
TTcGQ
v
−
=
()
đokmolkJc
v
./9.20
=
μ
KK đc xem nh khí lý
tng 2 nguyên t
(
)
đokgkJcc
vv
./721.029/9.20/
=
=
=
μ
μ
(
)
)(705.7520120721.005.1 kJxx
=
−
=
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.20
p.20
HT TUN 2
TUN 3
Chng 2: inh luât nhiêt đông th nhât va cac
qua trinh nhiêt đông c ban cua khi ly tng
Ngi son: TS. Hà anh Tùng
HBK tp HCM
8/2008
p.21
p.21