DE THI HKI 10-11 CO MA TRAN
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (88.83 KB, 4 trang )
ĐỀ THI HỌC KÌ II năm học 2008 - 2009
Môn : Hóa học, khối 8
MA TRẬN ĐỀ
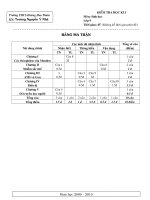
Nội dung
Biết Hiểu Vận dụng Tổng
TN TL TN TL TN TL
Oxi, không khí 2
0,5
2
0,5
1
2
5
3
Hidro, nước 1
0,25
2
0,5
1
0,25
1
3
5
4
Dung dòch 1
0,25
1
0,25
1
2
2
0,5
5
3
Tổng 4
1
7
4,25
4
3,75
15
10
oOo
Trêng THCS Thõa §øc THI HỌC KÌ II năm học 2008 - 2009
Hä & tªn : Môn : Hóa học, khối 8
Líp : 8 Thời gian : 45 phút ( không kể thời gian phát đề )
Điểm Lời phê của giáo viên
I/ TRẮC NGHIỆM: ( 3 điểm)
Khoanh tròn chữ cái trước câu trả lời đúng
C©u1: Ph¸t biĨu nµo sau ®©y vỊ oxi lµ kh«ng ®óng?
A.Oxi lµ phi kim ho¹t ®éng ho¸ häc rÊt m¹nh, nhÊt lµ ë nhÞªt ®é cao
B.Oxi t¹o oxit axit víi hÇu hÕt kim lo¹i
C.Oxi kh«ng cã mïi vµ vÞ
D.Oxi cÇn thiÕt cho sù sèng
C©u 2: Ngêi ta thu khÝ oxi qua níc lµ do
A. KhÝ oxi nhĐ h¬n níc B. KhÝ oxi tan nhiỊu trong níc
C. KhÝ O
2
tan Ýt trong níc D. KhÝ oxi khã ho¸ láng
C©u 3: Nguyªn liƯu ®Ĩ s¶n xt khÝ O
2
trong c«ng nghiƯp lµ
A. KMnO
4
B. KClO
3
C. KNO
3
D. Kh«ng khÝ
C©u 4: Ph¶n øng nµo díi ®©y lµ ph¶n øng ho¸ hỵp
A. CuO + H
2
-> Cu + H
2
O B. CaO +H
2
O -> Ca(OH)
2
C. 2KMnO
4
-> K
2
MnO
4
+ MnO
2
+ O
2
D. CO
2
+ Ca(OH)
2
-> CaCO
3
+H
2
O
C©u 5: Axit lµ nh÷ng chÊt lµm cho q tÝm chun sang mµu
A. Xanh B. §á C. TÝm D. Vàng
C©u 6: TÊt c¶ c¸c kim lo¹i trong d·y nµo sau ®©y t¸c dơng ®ỵc víi H
2
O ë nhiƯt ®é thêng?
A. Fe, Zn, Li, Sn B. Cu, Pb, Rb, Ag
C. K, Na, Ca, Ba D. Al, Hg, Cs, Sr
C©u 7: D·y chÊt nµo chØ toµn bao gåm axit
A. HCl; NaOH B. CaO; H
2
SO
4
C. H
3
PO
4
; HNO
3
D. SO
2
; KOH
C©u 8: D·y chÊt nµo chØ toµn bao gåm mi
A.
2
MgCl
; Na
2
SO
4
; KNO
3
B.Na
2
CO
3
; H
2
SO
4
; Ba(OH)
2
C.CaSO
4
; HCl; MgCO
3
D.H
2
O; Na
3
PO
4
; KOH
C©u 9: C¸c c©u sau, c©u nµo ®óng khi ®Þnh nghÜa dung dÞch?
A. Dung dÞch lµ hçn hỵp ®ång nhÊt cđa chÊt r¾n vµ chÊt láng
B. Dung dÞch lµ hçn hỵp ®ång nhÊt cđa chÊt khÝ vµ chÊt láng
C. Dung dÞch lµ hçn hỵp ®ång nhÊt cđa hai chÊt láng
D. Dung dÞch lµ hçn hỵp ®ång nhÊt cđa chÊt tan vµ dung m«i
C©u 10: Chän c©u ®óng khi nãi vỊ ®é tan.
§é tan cđa mét chÊt trong níc ë nhiƯt ®é x¸c ®Þnh lµ:
A. Sè gam chÊt ®ã tan trong 100g dung dÞch.
B. Sè gam chÊt ®ã tan trong 100g dung m«i
C. Sè gam chÊt ®ã tan trong níc t¹o ra 100g dung dÞch
D. Sè gam chÊt ®ã tan trong 100g níc ®Ĩ t¹o dung dÞch b·o hoµ
C©u 11: §Ĩ pha 100g dung dÞch CuS0
4
4% th× khèi lỵng níc cÇn lÊy lµ:
A. 95g B. 96g C. 97g D. 98g
C©u 12: Khi lµm bay h¬i 50g mét dung dÞch mi th× thu ®ỵc 0,5g mi khan. Hái lóc ®Çu, dung dÞch
cã nång độ bao nhiªu phÇn tr¨m
A. 1,1% B.1% C.1,5% D.3%
II/ TỰ LUẬN: (7đ)
Câu 1 : ( 2 điểm)
Đònh nghóa phản ứng oxi hóa khử. Chỉ ra chất khử, chất oxi hóa.
Vẽ sơ đồ sự khử sự oxi hóa trong phản ứng sau
0
t
2
2Mg + CO 2MgO + C→
Câu 2: ( 2 điểm ) Đònh nghóa nồng độ phần trăm của dung dòch. Công thức.
p dụng: Hòa tan 50g đường và 250 g nước được một dung dòch đường. Xác đònh nồng độ phần
trăm của dung dòch thu được.
Câu 3: ( 3 điểm)
Cho 2,4 g Mg tác dụng với HCl loãng.
a) Viết phương trình phản ứng xảy ra.
b) Tính khối lượng muối tạo thành
c) Tính thể tích khí H
2
thoát ra ở đktc.
( Cho Mg = 24, H = 1, S = 32, O = 16)
- Hết -
ĐÁP ÁN
I/ TRẮC NGHIỆM
1.B; 2C; 3D; 4B; 5B; 6C; 7C; 8A; 9D; 10D; 11B; 12B
II/ TỰ LUẬN
Câu 1:
- Đònh nghóa phản ứng oxi hóa khử ( 1 đ )
Chất khử : Mg; Chất oxi hóa CO
2
( 1 điểm )
Caâu 2 :
ct
dd
m
50
C% .100% .100% 16,7%
m 300
= = =
( 2 ñieåm )
Caâu 3 :
2
2
2
2
2 2
Mg
MgCl Mg
MgCl
H Mg
H
a)Mg 2HCl MgCl H ( 0,5 ñ)
m 2,4
b) n 0,1 mol ( 0,5 ñ)
M 24
n n 0,1 mol
m 0,1.95 9,5 gam ( 1 ñ)
c) n n 0,1 mol
V n.22,4 0,1.22,4 2,24lít ( 1 ñ)
+ → +
= = =
⇒ = =
= =
= =
= = =