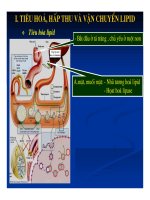
Phản ứng hình thành liên kết c s và c o mới từ chuyển hóa có định hướng liên kết c h của các dẫn xuất benzamide
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (2.48 MB, 94 trang )
ĐẠI HỌC QUỐC GIA TP. HCM
TRƯỜNG ĐẠI HỌC BÁCH KHOA TP. HCM
NGUYỄN VĂN VĨNH HÀ
PHẢN ỨNG HÌNH THÀNH LIÊN KẾT C-S VÀ C-O MỚI
TỪ CHUYỂN HÓA CÓ ĐỊNH HƯỚNG LIÊN KẾT C – H CỦA
CÁC DẪN XUẤT BENZAMIDE
Chuyên ngành: Kỹ thuật Hóa Học
Mã số: 8520301
LUẬN VĂN THẠC SĨ
TP. HỒ CHÍ MINH, tháng 03 năm 2023
CƠNG TRÌNH ĐƯỢC HỒN THÀNH TẠI
TRƯỜNG ĐẠI HỌC BÁCH KHOA-ĐHQG-HCM
Cán bộ hướng dẫn khoa học: TS. Nguyễn Thanh Tùng
GS.TS. Phan Thanh Sơn Nam
Cán bộ chấm nhận xét 1: PGS. TS. Trần Hoàng Phương
Cán bộ chấm nhận xét 2: TS. Nguyễn Đăng Khoa
Luận văn thạc sỹ được bảo vệ tại Trường Đại học Bách Khoa, ĐHQG TP.HCM
ngày 11 tháng 3 năm 2023
Thành phần Hội đồng đánh giá luận văn thạc sĩ gồm:
- TS. ĐẶNG BẢO TRUNG
- Chủ tịch hội đồng
- PGS.TS. TRẦN HOÀNG PHƯƠNG
- Phản biện 1
- TS. NGUYỄN ĐĂNG KHOA
- Phản biện 2
- TS. NGUYỄN THANH TÙNG
- Ủy viên
- TS. TRẦN PHƯỚC NHẬT UYÊN
- Thư ký
Xác nhận của Chủ tịch hội đồng đánh giá LV và Trưởng khoa quản lý chuyên ngành
sau khi luận văn đã được sửa chữa (nếu có).
CHỦ TỊCH HỘI ĐỒNG
TRƯỞNG KHOA KỸ THUẬT HĨA HỌC
ĐẠI HỌC QUỐC GIA TP.HCM
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
TRƯỜNG ĐẠI HỌC BÁCH KHOA
Độc lập - Tự do - Hạnh phúc
NHIỆM VỤ LUẬN VĂN THẠC SĨ
Họ và tên học viên
: NGUYỄN VĂN VĨNH HÀ
MSHV: 2070476
Ngày, tháng, năm sinh : 19/ 4/ 1996
Nơi sinh: TP. HCM
Chuyên ngành
Mã số: 8520301
: Kỹ Thuật Hóa Học
I. TÊN ĐỀ TÀI:
Tên tiếng Việt: Phản ứng hình thành liên kết C-S và C-O mới từ chuyển hóa có định
hướng liên kết C–H của các dẫn xuất benzamide.
Tên tiếng Anh: Formation of C-S and C-O bonds via directed functionalization of
C–H bonds in benzamides
II. NHIỆM VỤ VÀ NỘI DUNG:
̶
̶
Khảo sát điều kiện để phenoxyl hóa và thiol hóa có định hướng liên kết C–H
của các dẫn xuất benzamide, sử dụng nhóm định hướng 2-(methylthio)aniline.
Phân lập các dẫn xuất, đánh giá ảnh hưởng của nhóm thế đến hiệu suất sản
phẩm.
III. NGÀY GIAO NHIỆM VỤ:
IV. NGÀY HOÀN THÀNH NHIỆM VỤ:
V. CÁN BỘ HƯỚNG DẪN:
TS. Nguyễn Thanh Tùng; GS.TS. Phan Thanh Sơn Nam.
TP.HCM, ngày … tháng … năm 2023
CÁN BỘ HƯỚNG DẪN
CHỦ NHIỆM BỘ MƠN
TRƯỞNG KHOA KỸ THUẬT HĨA HỌC
LỜI CÁM ƠN
Để hoàn thành luận văn tốt nghiệp này, tôi đã nhận được rất nhiều sự giúp đỡ của
thầy cơ, của các cơ quan, của gia đình và đồng nghiệp.
Tôi xin chân thành gửi lời tri ân và cám ơn sâu sắc đến Ban giám hiệu Trường Đại
học Bách Khoa - Đại học Quốc Gia Thành phố Hồ Chí Minh, Ban chủ nghiệm Khoa Kỹ
thuật Hóa Học, Ban chủ nhiệm Bộ mơn Kỹ thuật Hóa Hữu cơ, Q Thầy/ Cô các Khoa/
Bộ môn đã giảng dạy và truyền đạt cho tơi những kiến thức bổ ích và tạo điều kiện cho tơi
trong suốt q trình học tập tại trường.
Tơi xin gửi lời tri ân chân thành đến GS.TS. Phan Thanh Sơn Nam- Trưởng Khoa Kỹ
thuật Hóa học đã tạo mọi điều kiện cho tôi được học tập và nghiên cứu khoa học; TS.
Nguyễn Thanh Tùng, thầy đã hỗ trợ và tận tình hướng dẫn tơi trong suốt thời gian thực
hiện đề tài tốt nghiệp.
Xin chân thành cám ơn các anh, chị và các bạn trong nhóm nghiên cứu và các anh chị
trong phịng thí nghiệm đã ln đồng hành và hỗ trợ tôi thực hiện tốt đề tài này.
Cuối cùng, tôi xin gửi lời tri ân sâu sắc đến ba mẹ, gia đình, người thân và bạn bè đã
ln ủng hộ, động viên và tạo mọi điều kiện tốt nhất cho tơi trong suốt thời gian qua.
Tp. Hồ Chí Minh, tháng 03 năm 2023
Nguyễn Văn Vĩnh Hà
i
TÓM TẮT
Luận văn nghiên cứu về các phản ứng phenoxyl và thiol hóa chọn lọc, có định hướng
liên kết C(sp2)−H của các dẫn xuất benzamide. Phản ứng được thực hiện thơng qua phản
ứng ghép đơi có chọn lọc giữa các dẫn xuất benzamide mang nhóm định hướng 2(methylthio)aniline với phenol và diphenyl disulfide với sự có mặt của các chất hỗ trợ trong
mơi trường khí oxygen và khơng khí. Luận văn này cũng nghiên cứu các điều kiện ảnh
hưởng tới hiệu suất của phản ứng như: nhiệt độ, môi trường, dung môi, xúc tác, loại base,
các chất phụ gia và thời gian phản ứng được khảo sát. Các tác chất và sản phẩm chính được
cơ lập bằng sắc ký cột, sau đó xác định cấu trúc bằng phương pháp sắc kí khí ghép khối
phổ (GC/MS) và phổ cộng hưởng từ hạt nhân (NMR). Phản ứng sau đó được khảo sát phạm
vi phản ứng từ các dẫn xuất khác nhau của tác chất benzamide với phenol và diphenyl
disulfide. Nghiên cứu này là một hướng tiếp cận mới khi chứng minh được vai trị của
nhóm định hướng hai càng N,S và xúc tác Cu(II) trong việc hoạt hóa trực tiếp liên kết
C(sp2)−H của benzamide.
ii
ABSTRACT
Directed phenoxylation and thiolation of C(sp2)−H bonds in (2-methylthio)anilides
with phenol and diphenyl disulfide derivatives were studied with respect to reaction
parameters. The couplings between benzamide bearing 2-(methylthio)aniline directing
group with phenol and diphenyl disulfide were successful in the presence of supporting
agents under oxygen or air atmosphere. Reaction conditions such as reaction temperature,
environment, solvent, catalyst, additives, and reaction time were investigated. Products
were isolated then characterized by NMR spectroscopy. The substrate scope was later
investigated. The methods provide new tactics for functionalization of the C(sp2)−H bond
in benzamides directed by a N,S- directing group.
iii
LỜI CAM ĐOAN
Tôi xin cam đoan luận văn này là cơng trình nghiên cứu của cá nhân tác giả, được thực
hiện dưới sự hướng dẫn của TS. Nguyễn Thanh Tùng và GS. TS. Phan Thanh Sơn Nam,
tại Phịng thí nghiệm trọng điểm ĐHQG-HCM Nghiên cứu cấu trúc vật liệu, Trường Đại
học Bách Khoa – ĐHQG-HCM. Số liệu và kết quả nghiên cứu trong luận văn này là hoàn
toàn trung thực và chưa từng được công bố ở các luận văn cùng cấp. Nếu không đúng như
đã nêu trên, tôi xin hồn tồn chịu trách nhiệm về đề tài của mình,
Nguyễn Văn Vĩnh Hà
iv
MỤC LỤC
LỜI CÁM ƠN ..................................................................................................................... i
TÓM TẮT .......................................................................................................................... ii
ABSTRACT ...................................................................................................................... iii
MỤC LỤC .......................................................................................................................... v
DANH MỤC HÌNH ẢNH ............................................................................................... vii
DANH MỤC BẢNG ......................................................................................................... ix
DANH MỤC ĐỒ THỊ........................................................................................................ x
DANH MỤC CHỮ VIẾT TẲT ........................................................................................ xi
LỜI GIỚI THIỆU .............................................................................................................. 1
CHƯƠNG 1. TỔNG QUAN ............................................................................................. 2
1.1. Phản ứng ether hóa và sự hình thành liên kết C(sp2)-O trong tổng hợp hữu cơ 2
1.1.1. Một số phương pháp hình thành liên kết C – O .................................................. 2
1.1.2. Phản ứng ether hóa trên cơ sở chuyển hóa có định hướng liên kết C−H.......... 6
1.2. Phản ứng thiol hóa và sự hình thành liên kết C(sp2)−S trong tổng hợp hữu cơ
12
1.2.1. Một số phương pháp hình thành liên kết C–S ................................................... 12
1.2.2. Chuyển hóa có định hướng C−H thành C−S ..................................................... 18
CHƯƠNG 2. THỰC NGHIỆM ...................................................................................... 23
2.1. Thiết bị - hóa chất ..................................................................................................... 23
2.2. Quy trình tổng hợp một số nguyên liệu .................................................................. 25
2.2.1. Tổng hợp N-(2-(methylthio)phenyl)benzamide (1a).......................................... 25
2.2.2. Quy trình tổng hợp Cu(OPiv)2 ............................................................................ 26
2.2.3. Quy trình tổng hợp các dẫn xuất của N-(2-(methylthio)phenyl)benzamide ... 26
2.3. Quy trình khảo sát phản ứng ................................................................................. 26
2.3.1. Phản ứng phenoxyl hóa dẫn xuất benzamide với phenol ................................. 26
v
2.3.2. Phản ứng thiol hóa có định hướng liên kết C−H trong dẫn xuất benzamide với
diphenyl disulfide ............................................................................................................. 28
CHƯƠNG 3. KẾT QUẢ VÀ BÀN LUẬN ..................................................................... 31
3.1. Phản ứng phenoxyl hóa giữa các dẫn xuất benzamide và phenol........................ 31
3.1.1. Khảo sát điều kiện phản ứng ................................................................................ 31
3.1.3. Khảo sát phạm vi của phản ứng ........................................................................... 39
3.2. Phản ứng thiol hóa giữa các dẫn xuất benzamide và diaryl disulfide ................. 41
3.2.1. Khảo sát điều kiện phản ứng ................................................................................ 41
3.2.2. Khảo sát phạm vi của phản ứng ........................................................................... 51
3.3. Đánh giá vai trị của nhóm định hướng và đề xuất cơ chế phản ứng .................. 53
KẾT LUẬN VÀ KIẾN NGHỊ ......................................................................................... 56
TÀI LIỆU THAM KHẢO ............................................................................................... 57
PHỤ LỤC ......................................................................................................................... 64
vi
DANH MỤC HÌNH ẢNH
Hình 1.1. Phản ứng Williamson .......................................................................................... 2
Hình 1.2. Phản ứng ghép đơi Ullmann. .............................................................................. 2
Hình 1.3. Phản ứng ghép đơi Chan-Evans. ......................................................................... 3
Hình 1.4. Phản ứng ghép đơi giữa nitroarene và arylboronic acid. .................................... 4
Hình 1.5. Phản ứng ether hóa đối xứng với hệ xúc tác sắt (III).......................................... 4
Hình 1.6. Phản ứng tổng hợp ether từ các hợp chất α-bromo carboxamide sử dụng hệ xúc
tác Cu(I). .............................................................................................................................. 5
Hình 1.7. Phản ứng tổng hợp alkyl aryl ether thơng qua xúc tác đồng và ánh đèn LED màu
xanh lam. ............................................................................................................................. 6
Hình 1.8. Phản ứng ether hóa với nhóm định hướng 8-aminoquinoline. ........................... 7
Hình 1.9. Phản ứng phenoxyl hóa các benzamide sử dụng 2-aminopyridine 1-oxide làm
nhóm định hướng. ................................................................................................................ 8
Hình 1.10. Phản ứng tạo dẫn xuất oxazepinone từ ether hóa chọn lọc liên kết C−H. ........ 9
Hình 1.11. Phản ứng dùng picolinamide làm nhóm định hướng để phenoxyl hóa C8−H của
naphthylamine. .................................................................................................................. 10
Hình 1.12. Q trình alkoxyl hóa có định hướng liên kết C8−H của các dẫn xuất 1-naphthyl
picolinamide với xúc tác cobalt(II). .................................................................................. 11
Hình 1.13. Phản ứng hoạt hóa trực tiếp liên kết C(sp2)−H với sự hỗ trợ của nhóm định
hướng 8-aminoquinoline và xúc tác nickel. ...................................................................... 12
Hình 1.14. Phản ứng tạo sulfide với xúc tác palladium. ................................................... 13
Hình 1.15. Phản ứng tổng hợp aryl dicarbamate từ aryl iodide với tetramethylthiuram
disulfide với sự hỗ trợ của xúc tác Cu2O. .......................................................................... 13
Hình 1.16. Phản ứng chuyển hóa thioester thành thioether thơng qua phản ứng decarbonyl
hóa. .................................................................................................................................... 14
Hình 1.17. Phản ứng ghép đôi giữa thiol và aryl halide được hỗ trợ bằng chiếu xạ với ánh
sáng nhìn thấy. ................................................................................................................... 15
Hình 1.18. Phản ứng chuyển hóa đa thành phần giữa halide dị vịng và alcohol. ............ 16
Hình 1.19. Phản ứng ghép đơi thiol và aryl chloride với sự hỗ trợ của xúc tác nickel. ... 16
vii
Hình 1.20. Phản ứng hình thành liên kết C–S từ muối arylsulfonium. ............................ 17
Hình 1.21. HFIP hỗ trợ sulfenyl hóa liên kết C–H. .......................................................... 18
Hình 1.22. Phản ứng thioether hóa với oxazoline làm nhóm định hướng. ....................... 19
Hình 1.23. Phản ứng thiol hóa sử dụng 4-tert-butyl-N-aminopyridinium ylide làm nhóm
định hướng một càng. ........................................................................................................ 20
Hình 1.24. Phản ứng thiol hóa acetanilide sử dụng xúc tác Rh(III). ................................ 20
Hình 1.25. Mục tiêu của đề tài. ......................................................................................... 22
Hình 2.1. Phản ứng tổng hợp N-(2-(methylthio)phenyl)benzamide (1a). ........................ 26
Hình 2.2. Phản ứng giữa N-(2-(methylthio)phenyl)benzamide và phenol ....................... 27
Hình
2.3.
Phản
ứng
tổng
hợp
2-methyl-N-(2-(methylthio)phenyl)-6-
(phenylthio)benzamide. ..................................................................................................... 29
Hình 3.1. Ảnh hưởng của nhóm định hướng 2-(methylthio)aniline. ................................ 54
Hình 3.2. Cơ chế thiol hóa sử dụng nhóm định hướng 2-(methylthio)aniline. ................ 55
viii
DANH MỤC BẢNG
Bảng 2.1. Trang thiết bị sử dụng ....................................................................................... 23
Bảng 2.2. Hóa chất sử dụng .............................................................................................. 23
Bảng 3.1. Ảnh hưởng của các loại base đến phản ứng phenoxyl hóa.Error!
Bookmark
not defined.
Bảng 3.2. Ảnh hưởng các nhóm thế của N-(2-(methylthio)phenyl)benzamide lên hiệu suất
sản phẩm. ........................................................................................................................... 39
Bảng 3.3. Hiệu suất phân lập sản phẩm với phản ứng thiol hóa. ...................................... 52
ix
DANH MỤC ĐỒ THỊ
Đồ thị 2.1. Mối quan hệ giữa tỷ lệ nồng độ và tỷ lệ diện tích tín hiệu giữa sản phẩm và nội
chuẩn. ................................................................................................................................. 28
Đồ thị 2.2. Mối quan hệ giữa tỷ lệ nồng độ và tỷ lệ diện tích pic giữa sản phẩm và nội
chuẩn .................................................................................................................................. 30
Đồ thị 3.1. Ảnh hưởng của nhiệt độ đến hiệu suất phản ứng phenoxyl hóa. .................... 32
Đồ thị 3.2. Ảnh hưởng của môi trường lên hiệu suất phản ứng phenoxyl hóa. ................ 33
Đồ thị 3.3. Ảnh hưởng của loại dung mơi lên hiệu suất phản ứng phenoxyl hóa............. 34
Đồ thị 3.4. Ảnh hưởng của các loại chất hỗ trợ lên hiệu suất phản ứng ........................... 35
Đồ thị 3.5. Ảnh hưởng của các chất phụ gia đến hiệu suất phản ứng phenoxyl hóa. ....... 37
Đồ thị 3.6. Ảnh hưởng của loại base đến hiệu suất phản ứng thiol hóa. .......................... 42
Đồ thị 3.7. Ảnh hưởng của lượng base đến hiệu suất phản ứng thiol hóa. ....................... 43
Đồ thị 3.8. Ảnh hưởng của các phức kim loại chu kì 4 lên hiệu suất phản ứng thiol hóa.44
Đồ thị 3.9. Ảnh hưởng của lượng Cu(OPiv)2 đến hiệu suất phản ứng thiol hóa............... 45
Đồ thị 3.10. Ảnh hưởng của chất phụ gia đến hiệu suất phản ứng thiol hóa. ................... 46
Đồ thị 3.11. Ảnh hưởng của dung môi đến hiệu suất phản ứng thiol hóa. ....................... 47
Đồ thị 3.12. Ảnh hưởng của lượng DMSO đến hiệu suất phản ứng thiol hóa. ................ 48
Đồ thị 3.13. Ảnh hưởng của nhiệt độ đến hiệu suất phản ứng thiol hóa. ......................... 49
Đồ thị 3.14. Ảnh hưởng của tỉ lệ mol tác chất đến hiệu suất phản ứng thiol hóa. ............ 50
Đồ thị 3.15. Ảnh hưởng của thời gian đến hiệu suất phản ứng thiol hóa. ........................ 51
x
DANH MỤC CHỮ VIẾT TẲT
DABCO
Triethylenediamine
DBU
1,8-Diazabicyclo[5.4.0]undec-7-ene
DCE
1,2-Dichloroethane
DCM
Dichloromethane
DMAc
Dimethylacetamide
DMAP
4-Dimethylaminopyridine
DMF
Dimethylformamide
DMSO
Dimethylsulfoxide
FID
Đầu dị ion hóa ngọn lửa
GC
Sắc kí khí
GC/MS
Sắc kí khí ghép đầu dị khối phổ
HFIP
Hexafluoro-2-propanol
MS
Khối phổ
N/A
Khơng áp dụng
NMP
N-Methyl-2-pyrrolidone
NMR
Phổ cộng hưởng từ hạt nhân
Rt
Thời gian lưu
TFA
Trifluoroacetic acid
TFE
Trifluoroethanol
TLC
Sắc ký lớp mỏng
xi
LỜI GIỚI THIỆU
Ether là một nhóm chức phổ biến, có thể tìm thấy trong nhiều hợp chất hữu cơ có giá
trị. Chúng là một phần quan trọng trong các nghiên cứu tổng hợp hữu cơ nhờ tính đa dạng
và ứng dụng rộng rãi trong đời sống cũng như nhiều ngành công nghiệp, từ nông nghiệp
(sử dụng trong thuốc trừ sâu), thực phẩm, hóa nhuộm, phụ gia xăng dầu, đến y học và dược
phẩm. Phản ứng tổng hợp ether Williamson được cho là phổ biến nhất để tổng hợp ether
được trình bày vào thế kỷ XIX. Ngoài ra, một phản ứng cũng thơng dụng khác là phản ứng
Ullmann có thể được sử dụng để tổng hợp ether và thioether. Các phản ứng trên mặc dù có
tính đa dụng cao, tuy nhiên lại vướng phải nhiều hạn chế như sử dụng nguyên liệu khơng
có sẵn, hạn chế về phạm vi cơ chế, tốn nhiều thời gian và chi phí. Vì vậy, việc phát triển
các phương pháp tổng hợp ether và thioether đơn giản, điều kiện phản ứng dễ tiếp cận, ít
tốn kém và ít độc hại là hướng nghiên cứu được quan tâm trong suốt nhiều năm qua. Việc
sử dụng các nhóm định hướng cùng với xúc tác kim loại để hoạt hóa trực tiếp liên kết C–
H đang là một trong những hướng tiếp cận nhiều tiềm năng, bởi vì nguyên liệu dùng chuyển
hóa đơn giản (là các liên kết C–H). Chính vì lẻ đó, nghiên cứu này nhằm mục đích đưa ra
một hướng đi mới trong việc phenoxyl hóa và thiol hóa liên kết C(sp2)–H của các dẫn xuất
benzamide với sự hỗ trợ của nhóm định hướng hai càng dạng N, S 2-(methylthio)aniline,
kết hợp với phức Cu(II).
1
CHƯƠNG 1. TỔNG QUAN
1.1.
Phản ứng ether hóa và sự hình thành liên kết C(sp2)-O trong tổng hợp hữu cơ
1.1.1. Một số phương pháp hình thành liên kết C – O
1.1.1.1. Phương pháp cổ điển
Vào giữa thế kỷ XIX, Alexander Williamson đã phát triển một phương pháp để tạo
nên các hợp chất ether từ alkyl halide và phenol, trong điều kiện dung môi hữu cơ và base
vô cơ, thông qua cơ chế phản ứng thế ái nhân SN2. Cơ chế phản ứng có thể được tóm tắt
như sau: phenol được tách proton tạo thành anion phenoxide, sau đó tiến hành phản ứng
thế ái nhân SN2 với tác nhân ái điện tử alkyl halide R−X (với R là một nhóm alkyl, X là
halogen) để tạo thành liên kết C−O (hình 1.1).
Hình 1.1. Phản ứng Williamson
Một trong những hạn chế lớn của phương pháp do Williamson đề xuất là phản ứng
chỉ xảy ra với các alkyl halide. Để thu được các aryl ether từ aryl halide, Ullmann đã phát
triển phương pháp xuất phát từ các aryl iodide hoặc bromide với vai trò là tác nhân ái điện
tử, sử dụng chất xúc tác là muối CuX (X là halogen), để phản ứng với phenol. Phản ứng
cũng có thể được sử dụng để tổng hợp các liên kết C−N và C−S mới từ amine và thiol
tương ứng. Về cơ chế, aryl halide được hoạt hóa bằng xúc tác CuX để tạo thành phức
Cu(III) trung gian, sau đó tham gia phản ứng với tác nhân phenol/amine/thiol thơng qua
phản ứng cộng hợp oxy hóa, rồi khử tách loại để tạo liên kết cacbon-dị tố mới (hình 1.2).
Hình 1.2. Phản ứng ghép đôi Ullmann.
2
Một phương pháp cổ điển khác có thể được sử dụng để tạo ra các aryl ether là đi từ
dẫn xuất arylboronic acid và hợp chất phenol, được giới thiệu lần đầu vào năm 1998 bởi
Chan [1] và Evans [2] (hình 1.3). Phản ứng sử dụng xúc tác Cu(OAc)2. Phản ứng này được
đặc biệt chú ý do có thể thực hiện ở nhiệt độ phịng và trong mơi trường khơng khí bình
thường, cũng như tính đa dạng và rẻ tiền của các arylboronic acid so với nhiều aryl halide
(đặc biệt là các aryl iodide đắt tiền và khó tìm thấy sẵn).
Hình 1.3. Phản ứng ghép đơi Chan-Evans.
1.1.1.2. Các nghiên cứu gần đây
Trên cơ sở các phản ứng Ullmann và Chan-Evans cổ điển, nhiều phương pháp tổng
hợp diaryl ether được phát triển, trong đó tập trung mở rộng cơ chất có thể tham gia phản
ứng và đơn giản điều kiện phản ứng. Năm 2012, Zhang cùng nhóm nghiên cứu đã cơng bố
một phương pháp cho phép ghép đôi các nitroarene và arylboronic acid với sự có mặt của
xúc tác Cu [3]. Phản ứng được khảo sát giữa 4-nitrobenzaldehyde và phenylboronic acid
tạo thành sản phẩm diarylether với hiệu suất cao trong điều kiện khơng cần ligand hỗ trợ
(hình 1.4). Phản ứng này đạt hiệu suất tối ưu khi sử dụng xúc tác là nano CuO, với base
Cs2CO3, thực hiện trong dung môi DMF. Nguyên tử O trong sản phẩm ether được đề xuất
có nguồn gốc từ nước. Các tác giả cũng thấy rằng việc bổ sung oxone (là hỗn hợp chất
muối 2KHSO5.KHSO4.K2SO4) giúp tăng hiệu quả phản ứng, có thể là do khả năng hỗ trợ
tạo phenolate từ arylboronic acid. Một loạt các dẫn xuất của arylboronic acid được sử dụng
để khảo sát phạm vi của phản ứng. Kết quả cho thấy nếu sử dụng các arylboronic acid có
nhóm thế hút điện tử, Cu(OAc)2 nên được sử dụng thay thế nano CuO để đạt hiệu suất tốt.
Đáng chú là phương pháp có thể áp dụng tốt cho dị vòng nitroarene (như 2-methyl-4nitropyridine).
3
NO2
Ar'
Me
+
ArB(OH) 2
O
H
88%
Ar'
Cs2CO3, DMF
O
N
OAr
nano CuO, oxone
R
O
R = OMe, 88%
R = NO2, 90%
(Cu(OAc)2
Hình 1.4. Phản ứng ghép đơi giữa nitroarene và arylboronic acid.
Vào năm 2018, nhóm nghiên cứu của tác giả Gunanathan đã cơng bố một phương
pháp dehydrate hóa chọn lọc để hình thành các ether đối xứng và bất đối xứng từ các
alcohol bậc 2 khác nhau [4]. Trong đó, phản ứng ether hóa trực tiếp 1-phenyl ethanol thành
aryl ether tương ứng diễn ra trong điều kiện xúc tác Fe(OTf)3 (OTf =
trifluoromethanesulfonate), NH4Cl, và dung môi dichloromethane cho hiệu suất sản phẩm
lên đến 81% chỉ sau 30 phút (hình 1.5). Đáng chú ý là các phản ứng này được thực hiện
trong điều kiện êm dịu (nhiệt độ phản ứng được tăng chậm từ 0 °C đến nhiệt độ phòng,
phản ứng diễn ra trong mơi trường khơng khí thơng thường). Các benzyl alcohol bậc 2
được khảo sát cho phản ứng ether hóa trong điều kiện tối ưu nhằm đánh giá khả năng áp
dụng của nhóm thế. Kết quả các alcohol có nhóm đẩy trên vòng aryl cho thấy khả năng
phản ứng tốt và hiệu suất cao, từ 87-93% sau khoảng 30 phút, trong khi nhóm thế hút điện
tử (như F) yêu cầu thời gian phản ứng dài hơn để đạt hiệu suất tốt.
Hình 1.5. Phản ứng ether hóa đối xứng với hệ xúc tác sắt (III).
4
Việc tổng hợp các aryl ether mà kế cận nguyên tử O là 1 cacbon bậc 3 đặc biệt khó
khăn khi thường yêu cầu điều kiện acid mạnh hoặc gia nhiệt tác chất dưới sự có mặt của
các base mạnh trong một khoảng thời gian dài. Một trong số các nguyên nhân là do sự cản
trở không gian của các nhóm alkyl bậc 3. Để khắc phục vấn đề này, nhóm nghiên cứu của
Kürti và cộng sự đã phát triển một hệ xúc tác Cu(I) để tổng hợp ether và thioether từ αbromo carboxamide hoặc carboxylic acid và phenol [5]. Xúc tác được sử dụng là phức
CuBr.SMe2, kết hợp với base K3PO4 và ligand cyclohexyl phosphine PCy3, trong dung môi
acetonitrile. Một loạt các phenol và alcohol khác nhau được thử nghiệm để khảo sát phạm
vi của phản ứng (hình 1.6). Điều kiện phản ứng đáp ứng tốt với các alcohol bậc 1 và các
phenol giàu điện tử, cho sản phẩm với hiệu suất cao ngay ở nhiệt độ phòng. Các phenol
trung hòa và nghèo điện tử hầu hết cho hiệu suất kém hơn, ví dụ như 4-nitrophenol khơng
tham gia được vào phản ứng. Hầu hết các alcohol bậc 2 đều có khả năng tham gia vào phản
ứng và cho hiệu suất tốt. Alcohol bậc 3 không phản ứng ở nhiệt độ phịng, tuy nhiên khi
gia nhiệt lên thì phản ứng xảy ra sau 24 giờ. Ngoài ra, các hợp chất dị vịng cũng có thể
tham gia tốt vào phản ứng này.
Hình 1.6. Phản ứng tổng hợp ether từ các hợp chất α-bromo carboxamide sử dụng hệ xúc
tác Cu(I).
Benzyl ether có thể thu được từ phản ứng ghép đôi theo cơ chế gốc tự do với sự hỗ
trợ của xúc tác Cu(I) và ánh sáng nhìn thấy [6]. Năm 2020, nhóm nghiên cứu của Chen và
cộng sự đã phát triển phương pháp tổng hợp benzyl ether từ phản ứng giữa oxime ester của
cyclobutanone, trong vai trò là một tiền chất tạo gốc tự do, và các phenol trong điều kiện
xúc tác CuCl, base iPr2NEt, dung môi CH2Cl2, và chiếu xạ bằng đèn LED màu xanh lam
5
(bước sóng từ 450 – 460 nm, cơng suất 7W). Phản ứng phù hợp với các oxime ester từ dẫn
xuất của cyclobutanone với nhiều nhóm chức đa dạng. Trong đó, các dẫn xuất chứa các
nhóm halogen như F, Br cho kết quả hiệu suất kém hơn các nhóm thế giàu điện tử trên
vịng thơm. Về phía các phenol, sử dụng các nhóm thế ở vị trí ortho được chứng minh là
hiệu quả, trong khi phản ứng với phenol có nhóm methoxy ở vị trí para chỉ thu được sản
phẩm với hiệu suất trung bình (32%) cùng nhiều sản phẩm phụ. Một số alcohol như
trifluoroethanol hoặc hexafluoroisopropanol cũng có thể được sử dụng làm tác nhân ghép
đơi (hình 1.7).
Hình 1.7. Phản ứng tổng hợp alkyl aryl ether thông qua xúc tác đồng và ánh đèn LED
màu xanh lam.
1.1.2. Phản ứng ether hóa trên cơ sở chuyển hóa có định hướng liên kết C−H
Chuyển hóa có định hướng liên kết C−H là một trong những hướng nghiên cứu thu
hút được nhiều sự quan tâm trong thời gian gần đây, nhờ khả năng chuyển hóa chọn lọc
các vị trí liên kết C−H mong muốn, phụ thuộc vào các nhóm định hướng (directing group)
được sử dụng. Một trong những q trình ether hóa có định hướng, chọn lọc liên kết C−H
đầu tiên được phát triển là của nhóm tác giả Daugulis và các cộng sự, cơng bố vào năm
2013. Trong đó, liên kết ortho C(sp2)−H của các dẫn xuất benzoic acid và các dẫn xuất
amine được ether hóa trực tiếp bằng cách sử dụng các nhóm định hướng hai càng, đơn điện
tích âm (monoanionic bidentate) dạng N,N [7]. Phản ứng giữa dẫn xuất 8-aminoquinoline
6
benzamide và các dẫn xuất phenol xảy ra thuận lợi với xúc tác (CuOH)2CO3, sử dụng O2
trong khơng khí làm chất oxy hóa, trong dung mơi DMF và base K2CO3 (hình 1.8). Các
phenol giàu và nghèo điện tử, bao gồm các chất mang các nhóm chức như thioether, ester,
halogen và amino, đều có thể tham gia phản ứng và cho hiệu suất sản phẩm tốt. Các alcohol
béo mạch hở, trifluoroethanol, carbitol, ethyl lactate đều là các tác nhân ghép đôi phù hợp
khi phản ứng chuyển sang hệ base tetramethylguanidine trong mơi trường pyridine. Đối
với các aminoquinoline benzamide, các nhóm thế như cyano-, trifluoromethyl-, nitro-,
methoxy- và các amide dị vòng đều có khả năng phản ứng tạo thành các sản phẩm thế một
lần với hiệu suất tương đối cao. Ngoài ra picolinamide cũng có thể sử dụng như một nhóm
định hướng phenoxyl hóa với hiệu suất trung bình.
Hình 1.8. Phản ứng ether hóa với nhóm định hướng 8-aminoquinoline.
2-Aminopyridine 1-oxide cũng có thể được sử dụng làm nhóm định hướng hai càng,
dạng N,O trong phản ứng tạo mono- hoặc bis- diarylether của các benzamide với sự có mặt
của xúc tác Cu(OAc)2 [8]. Với sự có mặt của các base là Cs2CO3 và DMAP, trong mơi
trường khơng khí và dung mơi ortho-xylene, phản ứng giữa 2-benzamidopyridine 1-oxide
và phenol tạo ra sản phẩm phenoxyl hóa một lần với hiệu suất cao. Khi đổi sang dung môi
pyridine và thay đổi tỉ lệ Cs2CO3/ DMAP, độ chọn lọc của sản phẩm phenoxyl hóa hai lần
tăng lên. Phản ứng này phù hợp với các amide có nhóm thế đa dạng về mặt điện tử ở các
7
vị trí ortho, meta và para của vịng phenyl, bao gồm các nhóm halogen, trifluoromethyl và
methoxy (hình 1.9). Các dẫn xuất benzoic acid có nhóm thế tại vị trí meta hoặc para cho
sản phẩm phenoxyl hóa một lần và hai lần, trong đó các dẫn xuất thế meta có xu hướng
hoạt hóa liên kết tại vị trí C−H ít bị cản trở khơng gian nếu sản phẩm phenoxyl hóa một
lần là sản phẩm chính.
Hình 1.9. Phản ứng phenoxyl hóa các benzamide sử dụng 2-aminopyridine 1-oxide làm
nhóm định hướng.
Tận dụng những hiểu biết về khả năng chuyển hóa chọn lọc, có định hướng liên kết
C−H bằng phenol, Ma và cộng sự đã phát triển một phương pháp ghép đơi–tạo vịng ngưng
tụ để tổng hợp các dẫn xuất oxazepinone [9]. Khi sử dụng xúc tác Cu2O và base Na2CO3
trong dung môi DMF, phản ứng giữa N-(quinolin-8-yl) benzamide và 2-bromo-4chlorophenol đạt hiệu suất tốt (hình 1.10). Các dẫn xuất ortho-halogen phenol và 8quinolinyl benzamide cũng được khảo sát để tìm hiểu phạm vi áp dụng của phương pháp.
Các nhóm thế rút điện tử như trifluoromethyl, fluoro hay chloro trên nhân thơm của 8quinolinyl benzamide cho sản phẩm với hiệu suất tốt hơn so với các nhóm thế đẩy điện tử
như methyl. Trong khi đó, bản chất điện tử của nhóm thế trên ortho-halogen phenol hầu
như ít ảnh hưởng đến sự tạo thành sản phẩm.
8
Hình 1.10. Phản ứng tạo dẫn xuất oxazepinone từ ether hóa chọn lọc liên kết C−H.
Chuyển hóa chọn lọc, có định hướng liên kết C−H tại vị trí C8 của dẫn xuất
naphthylamine thường gặp nhiều khó khăn, vì các cản trở khơng gian cũng như khó khăn
trong việc tạo phức vịng càng bền. Bằng cách sử dụng picolinamide làm nhóm định hướng,
phản ứng ether hóa chọn lọc liên kết C8−H của naphthylamide bằng arylboronic acid, với
sự hiện diện của phức Cu(II) và nguồn cấp nguyên tử O là nước xảy ra với hiệu suất cao
[10]. Cụ thể, phản ứng giữa N-(naphthalene-1-yl)picolinamide và phenylboronic acid với
sự hỗ trợ của xúc tác Cu(OAc)2, base Cs2CO3, dung môi DMSO tại nhiệt độ 130 °C trong
10 giờ tạo sản phẩm ether mong muốn với hiệu suất lên đến 82 %. Phản ứng này phù hợp
với nhiều nhóm chức khác nhau, bao gồm các arylboronic acid có chứa cả nhóm hút và
cho điện tử. Tuy nhiên, alkylboronic acid không thể tham gia phản ứng. Các dẫn xuất vinyl
hoặc các dị vòng thơm của boronic acid cũng có thể tham gia phản ứng để tổng hợp các
diaryl ether. Ngồi ra, các nhóm thế rút điện tử như 4-cyano và 4-nitro của naphthylamide
hoặc các amide mang vòng π mở rộng như pyrenyl cũng được oxy hóa hiệu quả để tạo ra
ether tương ứng (hình 1.11).
9
Hình 1.11. Phản ứng dùng picolinamide làm nhóm định hướng để phenoxyl hóa C8−H
của naphthylamine.
Phản ứng alkoxyl hóa liên kết C8−H của các dẫn xuất 1-naphthylamine sử dụng nhóm
định hướng picoliamide cũng có thể được thực hiện với xúc tác cobalt(II) (hình 1.12). Với
sự hỗ trợ của Co(OAc)2.2H2O, base DMAP, chất oxy hóa Ag2CO3, ở điều kiện 100 ℃,
phản ứng giữa N-(naphthalen-1-yl)picolamide và methanol xảy ra với hiệu suất tốt [11].
Phản ứng trên phù hợp với cả các nhóm cho hoặc rút điện tử trên vòng naphthalene, cho ra
các sản phẩm tương ứng với hiệu suất cao. Các nhóm thế dị vịng tại vị trí C4 của
naphthylamine cũng có khả năng tham gia phản ứng với hiệu suất tốt, trong khi các dẫn
xuất có ảnh hưởng của hiệu ứng khơng gian trên vịng quinoline thì khơng xảy ra phản ứng.
Các dẫn xuất rượu no, mạch thẳng và dẫn xuất phenol cũng có thể tham gia tốt vào phản
ứng. Tuy nhiên các alcohol có hiệu ứng khơng gian sẽ cho hiệu suất kém hơn.
10
O
N
H
+ MeOH
N
Co(OAc)2.2H2O
Ag2CO3, DMAP
NHPA
OMe
= PA
BocHN
NHPA
N
N
NHPA
OMe
35%
Br
NHPA
OMe
OMe
77%
76%
Hình 1.12. Q trình alkoxyl hóa có định hướng liên kết C8−H của các dẫn xuất 1naphthyl picolinamide với xúc tác cobalt(II).
Phản ứng tổng hợp trực tiếp các diaryl ether phức tạp, đối xứng từ phản ứng nhân đơi
(dimerization) các 8-quinolyl benzamide thơng qua hoạt hóa có định hướng liên kết
C(sp2)−H có thể xảy ra trong điều kiện xúc tác nickel [12]. Phản ứng được thực hiện với
điều kiện xúc tác Ni(OAc)2, chất oxy hóa Ag3PO4, trong dung môi DMAc bổ sung thêm 1adamantyl-COOK, và môi trường khí O2 (hình 1.13). Khi thực hiện loạt phản ứng với các
dẫn xuất của benzamide để khảo sát phạm vi phản ứng, các nhóm chức giàu điện tử như
methyl, tert-butyl, phenyl, và methoxy có thể tham gia phản ứng và cho ra các sản phẩm
diaryl ether với hiệu suất tốt. Ngồi ra các dẫn xuất benzamide với các nhóm thế rút điện
tử như các halogen, trifluoromethyl và methyl carboxylate cũng có khả năng tham gia phản
ứng để cho các sản phẩm ether với hiệu suất trung bình. Các diaryl ether bất đối xứng cũng
có thể được tổng hợp bằng phương pháp này, tuy nhiên sản phẩm thu được có độ chọn lọc
kém do sự hình thành của các diaryl ether đối xứng.
11